
9501
.pdf
40
N 1,931;
T2 303 1,931 585 К; t2 312 C.
k1 k
|
|
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Значение величины |
|
|
|
|
можно взять справочной литературы. |
||||||||||||||||||
p |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k 1 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
p2 |
p2 |
|
k |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Для адиабатного сжатия при |
|
|
10 величина |
|
|
|
|
1,931. |
|||||||||||||||
p |
p |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
||||||
Затраченная работа по уравнению (94) |
|
|
|
|
|
|
|
||||||||||||||||
l |
R |
|
(T T ) |
0,287 |
(303 585) 202 кДж/кг. |
||||||||||||||||||
k 1 |
|
|
|||||||||||||||||||||
|
1 |
|
2 |
|
|
|
0,4 |
|
|
|
|
|
|
|
|
|
|
||||||
Конечный объем определяется из уравнения состояния |
|
||||||||||||||||||||||
|
|
|
v |
RT2 |
|
|
287 585 |
0,168 м2 |
/ кг. |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
2 |
|
p |
|
|
|
|
1 106 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
6.5 Политропный процесс
Уравнение политропы в системе координат p-v (рис. 7) при постоянной теплоемкости
pvm const,
где т – показатель политропы.
Характеристикой политропного процесса является величина
|
|
φ |
u |
, |
(102) |
||
|
|
|
|
||||
|
|
|
|
q |
|
||
которая может быть определена из выражения |
|
||||||
|
|
φ |
m 1 |
, |
(103) |
||
|
|
|
|||||
|
|
|
m k |
|
|||
где k |
cp |
. |
|
|
|
|
|
|
|
|
|
|
|
||
cv
Пользуясь рис. 8, можно по величине показателя политропы определить ее относительное расположение в диаграмме p-v, а также выяснить характер процесса, т. е. имеет ли место подвод или отвод теплоты и увеличение, или уменьшение внутренней энергии газа.

41
Рис. 7 |
Рис. 8 |
Для процессов расширения
а) т < 1 – теплота подводится (q > 0), внутренняя энергия газа увеличива-
ется (Δи > 0);
б) k > т > 1 – теплота подводится (q > 0), внутренняя энергия газа умень-
шается (Δи < 0);
в) т > k – теплота отводится (q < 0), внутренняя энергия газа уменьшает-
ся (Δи < 0).
Для процессов сжатия
а) т < 1 – теплота отводится, внутренняя энергия газа уменьшается;
б) k > т > 1 – теплота отводится, внутренняя энергия газа увеличивается;
в) т > k – теплота подводится, внутренняя энергия газа увеличивается.
Зависимости между начальными и конечными параметрами процесса:
между p и v
p2 |
|
m |
|
||
|
v1 |
|
; |
(104) |
|
p1 |
|
||||
v2 |
|
|
|
||
42
между T и v
|
|
T2 |
|
v1 |
m 1 |
|
||||||
|
|
|
|
; |
(105) |
|||||||
T1 |
|
|
||||||||||
|
|
v2 |
|
|
|
|
||||||
между p и T |
|
|
|
|
|
|
|
|
||||
|
T2 |
|
|
p2 |
|
|
m 1 |
|
||||
|
|
|
m |
|
|
|||||||
|
|
|
|
|
|
. |
(106) |
|||||
T1 |
|
|
||||||||||
|
|
p1 |
|
|
|
|
||||||
Работу 1 кг газа в политропном процессе определяют по следующим формулам:
|
l |
1 |
|
(pv |
p v ); |
(107) |
|||||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
m 1 |
1 1 |
|
|
2 |
2 |
|
|
||||||||||
|
|
|
|
p1v1 |
|
|
|
|
v1 |
m 1 |
|
|
|||||||||
l |
|
|
|
|
|
|
|
|
|
; |
(108) |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
||||||||||
|
|
|
m 1 |
|
|
v2 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m 1 |
|
|
|
|
l |
p1v1 |
|
|
|
|
p2 |
m |
|
|
|
|
||||||||||
|
|
|
1 |
|
|
|
|
|
|
; |
|
(109) |
|||||||||
m 1 |
|
p |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
R |
|
|
(T T ). |
|
|
|
(110) |
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
m 1 |
1 |
|
|
|
2 |
|
|
|
|
|||||||
Если количество теплоты, участвующей в процессе, известно, то ра-
бота может быть также вычислена по формуле
l |
k 1 |
q. |
(111) |
|
|||
|
m 1 |
|
|
Для определения работы М кг газа нужно в формулах (107) - (109) за-
менить удельный объем v полным объемом газа V. Тогда
L |
1 |
|
(pV p V ); |
(112) |
|
m 1 |
|||||
|
1 1 2 2 |
|
|||
|
pV |
|
V |
m 1 |
|
|
||
L |
1 1 |
|
|
1 |
|
|
; |
(113) |
|
|
|
||||||
|
1 |
|
|
|||||
|
m 1 |
V2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|

|
|
|
43 |
|
|
|
|
|
|
|
p2 |
|
m 1 |
|
|
L |
pV1 1 |
m |
|||||
|
1 |
|
|
|
. |
||
m 1 |
p |
||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
Формулы (110) и (111) для М кг имеют следующий вид:
MR
L m 1(T1 T2);
L k 1Q. m 1
(114)
(115)
(116)
Теплоемкость политропного процесса можно найти из уравнения (102)
c cv
φ
или, заменяя φ его значением из уравнения (103),
m k c cv m 1.
Количество теплоты, сообщаемой газу или отнимаемой от него:
q c(t |
|
t ) c |
m k |
(t |
|
t ); |
(117) |
|||||||
|
|
|
||||||||||||
|
|
2 |
1 |
v |
m 1 |
2 |
|
|
1 |
|
|
|||
Q Mc(t |
|
t ) Mc |
m k |
(t |
|
t |
). |
(118) |
||||||
|
|
|
||||||||||||
|
2 |
|
1 |
|
v |
m 1 |
|
|
2 |
1 |
|
|
||
Величину Q можно также определить из формулы (116), если известна работа политропного процесса:
Q L |
k m |
. |
(119) |
|
|||
|
k 1 |
|
|
Изменение внутренней энергии газа в политропном процессе находим или по общей для всех процессов формуле
u ccm(t2 t1)
или по формулам
u φq m 1 q; m k
u m 1l. 1 k

44
Показатель политропного процесса т определяется из уравнения
m cp c. cv c
Если известны значения двух параметров в начальном и конечном со-
стоянии, то, пользуясь уравнениями (104) - (106), можно найти значение т из формул:
lg p1
m |
|
|
|
p2 |
; |
|
|
|
(120) |
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
lg |
v |
|
|
|
|
||||||||
|
|
|
2 |
|
|
|
|
|
|
||||||
v1 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
lg |
T2 |
|
|
|
|
||||||
m 1 |
|
T1 |
|
; |
(121) |
||||||||||
|
|
|
|
|
|
|
|||||||||
|
lg |
|
|
|
v |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|||||
|
|
|
v2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
m 1 |
|
|
|
lg |
T2 |
|
|
|
|
||||||
|
|
|
|
|
. |
(122) |
|||||||||
|
|
|
|
|
|
T1 |
|||||||||
|
|
|
|
|
|
|
|
||||||||
m |
lg |
|
|
|
p2 |
|
|
|
|
||||||
|
|
|
p1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Показатель политропы может быть также определен из уравнения (103).
Решая его относительно т, получаем
m |
kφ 1 |
. |
(123) |
|
|||
|
φ 1 |
|
|
В справочных материалах для облегчения расчетов приведены наиболее часто встречающиеся значения величин
|
|
1 |
|
|
|
m 1 |
|||
|
p2 |
|
|
|
p1 |
|
|
|
|
m |
m |
|
|||||||
|
|
и |
. |
||||||
|
|||||||||
p1 |
p2 |
||||||||
|
|
|
|
|
|
||||
Задача
1 кг воздуха при р1 = 0,5 МПа и t1 = 111 °С расширяется политропно до давления р2 = 0,1 МПа.
Определить конечное состояние воздуха, изменение внутренней энергии,

45
количество подведенной теплоты и полученную работу, если показатель полит-
ропы т=1,2.
Решение
Определяем начальный объем воздуха:
v |
RT1 |
|
287 |
384 |
0,22 м3/ кг. |
p |
|
106 |
|||
1 |
0,5 |
|
|||
|
1 |
|
|
|
|
Конечный объем воздуха находим из уравнения (104):
1
1
v2 v1 p1 m 0,22 51,2 0,84 м3/ кг.
p2
Конечную температуру проще всего получить из характеристического уравнения
|
|
|
|
|
T |
|
|
|
p v |
0,1 106 0,84 |
293 К. |
|||||||
|
|
|
|
|
|
|
|
|
2 2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
287 |
|
|||||||
|
|
|
|
|
|
2 |
|
|
|
R |
|
|
||||||
Величину работы находим из уравнения (110): |
||||||||||||||||||
l |
R |
(T T ) |
287 |
(384 293) 130600 Дж/ кг 130,6 кДж/ кг. |
||||||||||||||
|
|
|||||||||||||||||
|
m 1 |
1 2 |
|
|
0,2 |
|
|
|
|
|
|
|
|
|||||
Изменение внутренней энергии |
|
|||||||||||||||||
|
|
u c (T |
|
T ) |
20,93 |
(293 384) 65,8 кДж/ кг. |
||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
v |
2 |
|
|
1 |
28,96 |
|
|
|
||||||
Количество теплоты, сообщенной воздуху, по уравнению (117) |
||||||||||||||||||
|
q c |
|
m k |
(t |
|
t ) 0,72 |
1,2 1,4 |
(20 111) 65,8 кДж/ кг. |
||||||||||
|
|
m 1 |
|
|
||||||||||||||
|
|
v |
|
|
2 |
|
|
1 |
|
|
|
|
1,2 1 |
|
||||
Нетрудно видеть, что в этом процессе внешняя работа совершается за счет подведенной теплоты и уменьшения внутренней энергии. Исходя из этого,
можно проверить полученные результаты следующим образом:
q u l;
l q u 65,8 ( 65,8) 131,6 кДж/кг.
Этот же результат нами получен выше другим путем.
46
7. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Второй закон термодинамики определяет направление, в котором проте-
кают процессы, устанавливает условия преобразования тепловой энергии в ме-
ханическую, а также определяет максимальное значение работы, которая может быть произведена тепловым двигателем.
Второй закон термодинамики математически может быть выражен сле-
дующим образом:
dS |
dQ |
, |
(124) |
|
|||
|
T |
|
|
где dS – бесконечно малое приращение энтропии системы; dQ – бесконечно ма-
лое количество теплоты, полученной системой от источника теплоты; Т – абсо-
лютная температура источника теплоты.
Знак неравенства соответствует необратимым процессам, а знак равенст-
ва – обратимым процессам. Следовательно, аналитическое выражение второго
закона термодинамики для бесконечно малого обратимого процесса имеет вид
dQ TdS, |
(125) |
а так как согласно первому закону термодинамики
dQ dU pdV,
то уравнение (125) принимает вид
TdS dU pdV.
7.1 Энтропия идеального газа
Основным уравнением для определения изменения энтропии в обратимом процессе является выражение
ds |
dq |
. |
(126) |
|
|||
|
T |
|
|
Поскольку в технической термодинамике приходится иметь дело не с аб-
солютным значением энтропии, а с ее изменением, отсчет значений энтропии можно вести от любого состояния. Для газов принято считать значение энтро-
47
пии равным нулю при нормальных условиях, т. е. при р = 101325 Па и
Т = 273,15 К (760 мм рт. ст. и 0 °С).
Определение энтропии для любого состояния газа, отсчитанной от нор-
мального состояния, производят по следующим формулам.
При переменной теплоемкости, исходя из линейной зависимости ее от
температуры:
s a |
v |
ln |
|
T |
|
Rln |
|
|
v |
|
b(T 273); |
(127) |
|||||||||||||||||||||
273 |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|||
s a |
p |
ln |
|
|
T |
|
|
|
|
Rln |
|
|
|
p |
|
b(T 273); |
(128) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
273 |
|
|
|
|
|
|
|
|
pн |
|
|
|
|
|
|
|
|
|
|||||||||||||
s a |
v |
ln |
|
p |
a |
p |
ln |
|
|
v |
b(T 273). |
(129) |
|||||||||||||||||||||
|
p |
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
||||||
При постоянной теплоемкости |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
s c ln |
|
T |
|
|
Rln |
|
v |
; |
(130) |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
v |
273 |
|
|
|
|
|
|
|
|
|
v |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|||
|
|
|
|
s c |
p |
ln |
|
T |
Rln |
|
|
p |
; |
(131) |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
273 |
|
|
|
|
|
|
|
|
|
|
|
p |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|||
|
|
|
|
s c ln |
|
p |
|
c |
|
ln |
|
v |
. |
(132) |
|||||||||||||||||||
|
|
|
|
p |
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
p |
|
|
|
v |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
н |
|
|||||
Изменение энтропии между двумя произвольными состояниями газа 1 и 2
определяют по следующим формулам.
При переменной теплоемкости, считая зависимость ее от температуры линейной:
|
s |
2 |
s |
|
a |
v |
ln |
T2 |
Rln |
v2 |
|
|
b(T |
T ); |
(133) |
|||||||||||
|
|
T |
|
v |
||||||||||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|
||||||||
s |
2 |
s |
a |
p |
ln |
T2 |
|
Rln |
p2 |
|
|
b(T |
T ); |
(134) |
||||||||||||
T |
|
|
|
|||||||||||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
p |
2 |
1 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
||||||
s |
2 |
s |
a |
v |
ln |
p2 |
|
a |
p |
ln |
v2 |
|
|
b(T |
T ). |
(135) |
||||||||||
p |
v |
|
|
|||||||||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
2 |
1 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
||||||

48
При постоянной теплоемкости
s |
|
|
s |
c ln |
T2 |
Rln |
v2 |
; |
(136) |
||||||||||||||
|
|
T |
|
|
|||||||||||||||||||
|
|
2 |
1 |
|
|
v |
|
|
|
|
|
|
|
|
v |
|
|||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|||||||
s |
|
|
|
s |
c |
p |
ln |
T2 |
|
Rln |
p2 |
; |
(137) |
||||||||||
|
|
|
T |
|
|
||||||||||||||||||
|
2 |
|
1 |
|
|
|
|
|
|
|
p |
|
|||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
||||||
s |
|
|
s |
c |
|
ln |
p2 |
|
c |
|
ln |
v2 |
. |
(138) |
|||||||||
|
|
|
|
|
|
||||||||||||||||||
|
2 |
|
1 |
v |
|
|
|
p |
|
p |
|
|
|
v |
|
||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
||||||
Уравнения кривых различных термодинамических процессов в системе координат T-s имеют следующий вид (при постоянной теплоемкости):
уравнение изохоры
s |
2 |
s |
c ln |
T2 |
; |
(139) |
|
||||||
|
1 |
v |
T |
|
||
|
|
|
|
1 |
|
|
уравнение изобары |
|
|
|
|
|
|
s |
2 |
s |
c ln |
T2 |
; |
(140) |
|
||||||
|
1 |
v |
T |
|
||
|
|
|
|
1 |
|
|
Взаимное расположение изохоры и изобары показано на рис. 9;
Рис. 9
уравнение изотермы
T const, |
(141) |
49
при этом изменение энтропии в изотермическом процессе
s |
2 |
s Rln |
v2 |
Rln |
p1 |
; |
|
|
|
||||||
|
1 |
|
v1 |
|
p2 |
(142) |
|
|
|
|
|
|
|||
уравнение адиабаты |
|
|
|
|
|
|
|
|
|
|
s const. |
(143) |
|||
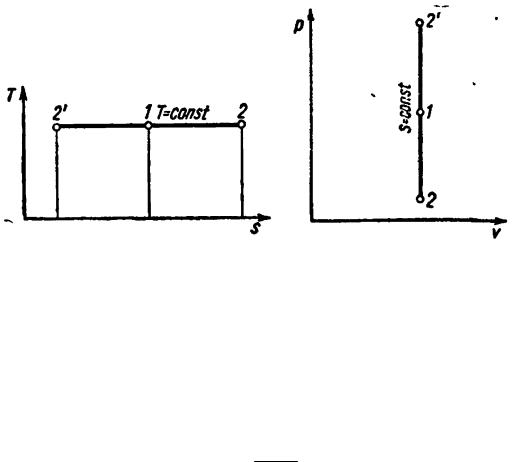
Изображение изотермы и адиабаты в системе координат T-s дано со-
ответственно на рис. 10 и 11.
Рис. 10 |
Рис. 11 |
Уравнение политропы
s |
2 |
s |
cln |
T2 |
, |
(144) |
|
||||||
|
1 |
|
T1 |
|
|
|
|
|
|
|
|
|
где
m k c cv m 1.
Широким распространением при решении термодинамических задач пользуется диаграмма T-s. Адиабаты в этой диаграмме изображаются вертика-
лями, изотермы – горизонталями, изохоры и изобары идеального газа – лога-
рифмическими кривыми.
На рис. 12 дана небольшая часть диаграммы T-s для воздуха, на которой нанесены изотермы, адиабаты и изобары (отсутствуют изохоры).
Необходимо иметь в виду, что значения энтропии зависят от теплоемко-
стей, поэтому для каждого газа нужна отдельная диаграмма T-s.
