
9501
.pdf
130
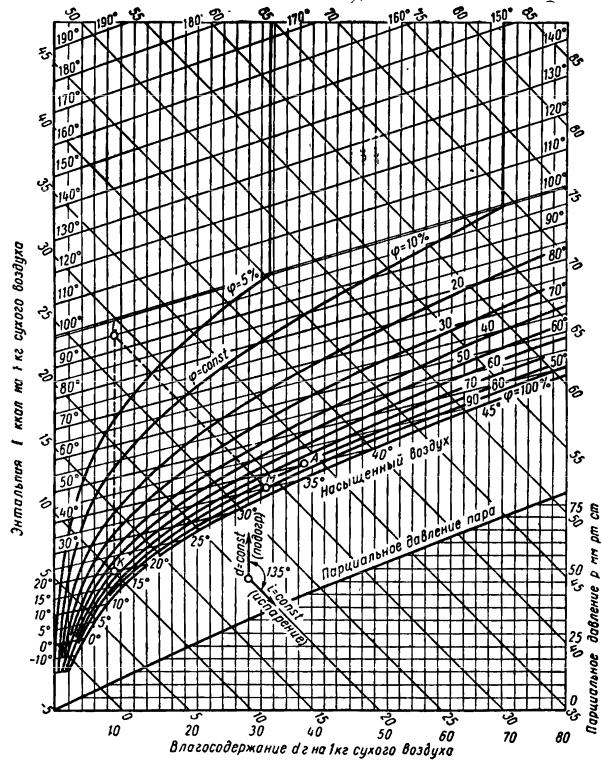
оси в ней проведены под углом 135° (рис. 81).
В выполненных диаграммах наклонная ось влагосодержания не вычерчи-
вается, а вместо нее из начала координат проводится горизонталь, на которую значения d спроектированы с наклонной оси. Поэтому линии I = const идут на-
клонно, параллельно наклонной оси абсцисс, линии же d = const идут верти-
кально, параллельно оси ординат. В диаграмме I-d построены также изотермы
(t = const), весьма близкие к прямым.
Рис. 81
Кривая φ = 100% является своего рода пограничной кривой, кривой на-
сыщения. Вся область над линией φ = 100% соответствует влажному насыщен-
ному воздуху (для различных значений φ). Область, лежащая под этой линией,
характеризует состояние воздуха, насыщенного водяным паром.
131
Рис. 82
Кроме указанных кривых, в последних изданиях диаграмм I-d приведены также линии постоянных истинных температур мокрого термометра tм. Внизу диаграммы построена кривая рп = f (d) по формуле (280) в прямоугольной сис-
теме координат. По оси ординат отложено парциальное давление в мм рт. ст., а
по оси абсцисс – влагосодержание.

132
На рис. 82 дана диаграмма I-d для воздуха при барометрическом давлении
В = 745 мм рт. ст. Процесс подогрева или охлаждения влажного воздуха изо-
бражается на этой диаграмме как процесс при постоянном влагосодержании
(d = const), а процесс сушки – как процесс с постоянной энтальпией (i = const).
Диаграмма I-d дает возможность по двум каким-либо параметрам влажного воздуха (обычно φ и t) определить I, d и рп. По этой диаграмме можно также найти и точку росы. Для этого нужно из точки, характеризующей состояние воздуха, провести вертикаль (d = const) до пересечения с линией φ = 100 %.
Изотерма, проходящая через эту точку, определяет температуру точки росы.
Состояние влажного воздуха можно также определить по диаграмме I-d,
если известны показания сухого и мокрого термометров психрометра. Внося необходимую поправку в показание мокрого термометра по формуле (289), на-
ходим истинную температуру мокрого термометра. Далее из точки, соответст-
вующей относительной влажности φ = 100 % и истинной температуре мокрого термометра, проводят параллельно изотерме tм, прямую до пересечения с изо-
термой сухого термометра tc. Полученная точка характеризует состояние влаж-
ного воздуха.
Задача
Определить влагосодержание воздуха при температуре t = 60 °С и баро-
метрическом давлении В = 99325 Па (745 мм рт. ст.), если относительная влаж-
ность воздуха φ = 60 %.
Решение
По формуле (278)
dρп , ρн
а так как по уравнению (277)
φpп , pн

133
то
pп 0,6 0,019917 0,012 МПа.
По таблицам перегретого водяного пара для р = 0,012 МПа и t = 60 °С на-
ходим v = 12,78 м3/кг. Тогда
ρп |
|
1 |
0,078 кг/ м3 . |
|
12,78 |
||||
|
|
|||
Парциальное давление воздуха
pв p pп 99325 12000 87325 Па 0,0873 МПа.
Плотность влажного воздуха
|
|
|
p |
0,0873 |
106 |
3 |
|
|
ρ |
в |
|
в |
|
|
|
0,913 кг/м |
, |
|
287 (273 |
60) |
||||||
|
|
RT |
|
|
||||
поэтому
d0,078 0,0854 кг/ кг 85,4 г/ кг. 0,913
Значение d можно также определить из формулы (279):
d 622 |
pп |
622 |
0,012 |
85,2 г/ кг. |
B pп |
|
|||
|
|
0,0873 |
||
14. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Химическими процессами называются процессы, в результате которых образуются новые вещества, отличающиеся по своим физическим и химиче-
ским свойствам от исходных веществ.
Все химические процессы или химические реакции сопровождаются или выделением теплоты, или ее поглощением. Реакции, происходящие с выделе-
нием теплоты, называются экзотермическими, а реакции, сопровождающиеся поглощением теплоты – эндотермическими.
Химические реакции обычно рассматриваются при постоянном объеме или постоянном давлении и одновременно при постоянной температуре до и после реакции. Такие реакции называются соответственно изохорно-
изотермическими и изобарно-изотермическими реакциями.
При протекании химических реакций число молей реагирующих веществ может оставаться неизменным ( п = п2 – п1 = 0), увеличиваться (Δп = п2 – п1 > 0)
или уменьшаться ( п = п2 – п1 < 0), где п1 и п2 – число молей реагентов соответ-
ственно до и после реакции, а п – изменение числа молей.
Первый закон термодинамики в применении к химическим процессам имеет следующий вид;
q U L, |
(290) |
где U – изменение внутренней энергии системы; q – теплота, подводимая к системе или отданная ею;
L – работа, совершаемая системой или полученная ею.
Изменение внутренней энергии U считается положительным при увели-
чении внутренней энергии системы и отрицательным – при ее уменьшении.
Теплота q, подводимая к системе, считается положительной, а отводимая от нее – отрицательной.
Работа L, совершаемая системой, считается положительной, а получаемая ею – отрицательной.
Работа, производимая системой в химических процессах, может состоять
135
из работы расширения и работы, не связанной с изменением объема системы. В
дальнейшем будем считать, что расширение есть единственный вид работы, со-
вершаемый системой (для подавляющего большинства химических процессов это в действительности так). Тогда уравнение (290) первого закона термодина-
мики принимает вид
v2
q U pdv. |
(291) |
v1 |
|
Тепловым эффектом Q реакции называется количество теплоты, которой система обменивается с внешней средой при условии, что температура до и по-
сле реакции остается одной и той же. Знаки теплоты, подводимой к системе или отводимой от нее, и теплового эффекта реакции противоположны. По-
этому тепловой эффект экзотермической реакции считается отрицательным, а
эндотермической – положительным.
Для изохорных процессов уравнение (291) принимает вид
qv U.
Следовательно, |
|
Qv U U1 U2, |
(292) |
т. е. тепловой эффект Qv в изохорных реакциях равен уменьшению внутренней энергии системы.
Для изобарных реакций уравнение (291) имеет вид
qp I,
следовательно,
Qp I I1 I2, |
(293) |
т. е. тепловой эффект Qp в изобарных реакциях равен уменьшению энтальпии системы.
Соотношение тепловых эффектов Qv и Qp для идеальных газов зависит от
изменения в реакции числа молей: |
|
Qv Qp μR nT. |
(294) |
Таким образом, в реакциях, где число, молей уменьшается |
(Δn < 0), |
136
Qv < Qp; в реакциях, где число молей увеличивается (Δn > 0), Qv > Qp, а в реак-
циях, где число молей остается неизменным (Δn = 0), Qv < Qp.
При пользовании уравнением (294) следует иметь в виду, что если в реак-
ции участвуют твердые или жидкие вещества, то при определении n следует брать лишь изменение числа молей газообразных компонентов реакции.
Русским академиком Г. И. Гессом в 1840 г. опытным путем был установ-
лен следующий закон, которому дано имя Гесса: тепловой эффект реакции не зависит от пути ее протекания и от промежуточных процессов, а зависит лишь от начального и конечного состояния.
Из закона Гесса вытекают два важнейших следствия:
1. Тепловой эффект реакции равен сумме теплот образования конечных продуктов реакции минус сумма теплот образования исходных веществ:
Q Qобр.кон Qобр.исх. |
(295) |
2. Тепловой эффект реакции равен сумме теплот сгорания исходных |
|
веществ минус сумма теплот сгорания продуктов реакции: |
|
Q Qср.исх Qср.кон. |
(296) |
Пользуясь этими следствиями, можно вычислить тепловые эффекты ре-
акций, осуществление которых на практике затруднительно или совершенно
невозможно.
Тепловые эффекты химических реакций изменяются с изменением тем-
пературы. Закон изменения теплового эффекта в зависимости от температуры
определяется уравнением
Q Q αT βT2 |
γT3, |
(297) |
0 |
|
|
где Q – тепловой эффект реакции при температуре Т, К; Q0 – тепловой эффект реакции при абсолютном нуле; α, β, γ – коэффициенты, определяемые на осно-
вании уравнения реакции и уравнений истинных мольных теплоемкостей реа-
гентов.
Для реакции вида |
|
nAB nBB |
nCC nDD |

137
и уравнения температурной зависимости истинной теплоемкости
μc a bT dT2
коэффициенты α, β и γ соответственно:
(na1) (na2) nAaA nBaB nCaC nDaD;
(nb1) (nb2) nAbA nBbB nCbC nDbD ; 2 2
(nd1) (nd2) nAdA nBdB nCdC nDdD . 3 3
(298)
(299)
(300)
Величины nA, nB, nC и nD – числа молей веществ A, В, С и D, а величины а, b и d с соответствующими индексами – коэффициенты уравнения истинной те-
плоемкости каждого реагента. Величина Q0, входящая в уравнение (297), опре-
деляется по значению теплового эффекта реакции для известной температуры.
Формула (297) дает возможность найти значение теплового эффекта ре-
акции при любой температуре, если известны тепловой эффект реакции при ка-
кой-либо температуре и зависимости теплоемкостей всех реагентов от темпера-
туры.
Изменение теплового эффекта реакции при изменении температуры мо-
жет быть также определено по таблицам теплоемкостей. В этом случае следует пользоваться формулой
Q |
Q |
n |
μc t2 t |
2 |
n |
μc t1 t , |
(301) |
2 |
1 |
1 |
0 |
2 |
0 1 |
|
где Q1 – тепловой эффект реакции при температуре t1 °С; Q2 – тепловой эффект
реакции при температуре t2 °С; n1 μc t02 – сумма произведений из числа молей
каждого исходного вещества на его среднюю мольную теплоемкость в преде-
лах от 0 до t2 °С; n2 μc t01 – сумма произведений из числа молей каждого исход-
ного вещества на его среднюю мольную теплоемкость в пределах от 0 до t1 °С.
Характеристическими или термодинамическими функциями называют такие функции состояния системы, при помощи которых можно наиболее про-
сто определить термодинамические свойства системы, а также находить усло-
вия равновесия в ней. К этим функциям принадлежат: внутренняя энергия U,
138
энтальпия I, энтропия S, изохорный потенциал F и изобарный потенциал Z.
Наиболее удобными для характеристики химических процессов являются по-
следние две функции. Убыль этих функций в обратимых изохорно-изотер-
мических и изобарно-изотермических реакциях позволяет определить макси-
мальную работу этих реакций, являющуюся мерой химического сродства.
Изохорный потенциал определяется уравнением
F U TS, |
(302) |
а изобарный потенциал – уравнением |
|
Z U TS pv I TS. |
(303) |
Максимальная работа в обратимых изохорно-изотермических реакциях |
|
равна уменьшению изохорного потенциала системы: |
|
Lv F1 F2. |
(304) |
Максимальная работа в обратимых изобарно-изотермических реакциях
(за вычетом работы расширения) равна уменьшению изобарного потенциала системы:
Lp Z1 Z2. |
(305) |
||
Концентрация вещества может быть выражена различно. Чаще всего ее |
|||
определяют числом молей вещества в единице объема. Таким образом, |
|
||
C |
n |
, кмоль/ м3 , |
(306) |
|
|||
V |
|
||
где п – число кмолей вещества; V – объем вещества в м3.
При постоянной температуре реакции концентрации отдельных веществ прямо пропорциональны их парциальным давлениям:
C1 |
|
pi |
, |
(307) |
|
||||
|
|
μRT |
|
|
где pi – парциальное давление отдельного газообразного вещества в газовой смеси; μR – газовая постоянная; Т – температура реакции в К.
139 |
|
|
|
Истинную скорость реакции находим из уравнения |
|
||
w |
dC |
. |
(308) |
|
|||
|
dτ |
|
|
Знак минус относится к случаю, когда С обозначает концентрацию одно-
го из исходных веществ, количество которых в ходе реакции уменьшается.
Скорость химической реакции пропорциональна концентрации веществ,
принимающих участие в реакции. Если для реакции вида
A B |
C D |
начальные концентрации элементов А, В, С и D обозначить соответственно че-
рез СА, СB, СC и CD, то на основании закона действующих масс скорость прямой реакции, идущей слева направо
w1 k1CACB,
а скорость обратной реакции, идущей справа налево
w2 k2CCCD,
где k1 и k2 – коэффициенты пропорциональности, называемые константами скорости химической реакции.
Для реакции вида
aA bB |
cC dD, |
где а, b, с, d – число молей элементов А, В, С и D, скорости прямой и обратной при химическом равновесии реакций выражаются соответственно уравнениями:
w1 kC1 aACbB
и
w2 k2CcCd .
C D
Величина
K |
|
|
k |
2 |
|
cacb |
, |
(309) |
|
c |
|
A B |
|||||||
k |
cccd |
||||||||
|
|
|
|
|
|||||
|
|
|
|
1 |
|
C D |
|
|
|
в которой сА, св, сс, cD – концентрация веществ в момент равновесия, называется
константой равновесия реакции.
