
6885
.pdf
воздух [см2/с]; β – стехиометрический коэффициент кислорода в реакции горения.
Фото 2. Полуавтоматический прибор Rapid Tester RT-1 для определения температуры воспламенения в закрытом тигле (печатается с официаль-
ного сайта Crea Laboratory Technologies).
Температура самовоспламенения соответствует наи-
меньшей температуре горючего вещества, при нагреве до которой происходит резкое увеличение скорости экзотермической реакции, приводящее к возникновению пламенного горения и/или взрыва.
Из-за сложности прямого измерения температуры самовоспламенения газов или паров за температуру самовоспламене-
ния Тсамовоспл. принимают температуру стенки реакционного сосуда, в котором наблюдают самовоспламенение. Эта температу-
ра зависит от условий тепломассоообмена как внутри реакционного сосуда, так и самого сосуда с окружающей средой, а также каталитического влияния стенок сосуда.
Устройство, в котором осуществляется определение температуры самовоспламенения, представлено на рис. 8. В корпусе воздушного термостата (1) размещены электрическая спираль нагревателя (2), вентилятор (3), реакционный сосуд (4), крышка термостата (5), зеркало (6) и термопары (7).
51

Рис.8.Устройство для определения температуры самовоспламенения [1]
Для некоторых горючих жидкостей температуры самовоспламенения приведены в табл. 3 .
Структура и механизм горения жидкостей
Структура диффузного факела пламени над зеркалом горючей жидкости отличается от горения газовой смеси тем, что поступающие с поверхности жидкости горючие пары смешиваются с кислородом воздуха не за счет кинетической энергии вытекающего газового потока, а более медленно по механизму кон-
вективной и молекулярной диффузии (рис. 9). Горячие продукты сгорания устремляются вверх, а на их место из окружающего пространства поступает холодный воздух, который разбавляет горючие пары. От факела пламени к поверхности зеркала жидкости поступает лучистая энергия, нагревающая поверхностные слои жидкости, интенсифицируя процесс еѐ испарения. По мере развития процесса пламя переходит в турбулентный режим горения и будет расти до тех пор, пока не установится режим теплового равновесия и газодинамического равновесия. Максимальная температура турбулентного диффузионного пламени большинства горючих жидкостей не превышает 1250 – 1350 оС,
52

устанавливается относительно стационарный процесс испарения
и выгорания паров.
Продукты горения
 Т ≈ 1250 оС
Т ≈ 1250 оС
Воздух
Воздух
Т ≈ 50 – 250 оС
Рис. 9 . Распределение температур в пламени при горении жидких веществ
Скорость выгорания жидкостей
С температурой кипения связана такая характеристика жидкостей, как скорость выгорания. Под этим термином понимается линейная скорость уменьшения высоты слоя жидкости при ее горении со свободной поверхности в единицу времени. Скорость выгорания зависит от температуры, диаметра резервуара, уровня жидкости в резервуаре, скорости ветра и т.п.
Для резервуаров малого диаметра скорость выгорания сравнительно велика. При увеличении диаметра она сначала уменьшается, потом снова возрастает, пока не достигнет постоянной величины. Такая сложная зависимость связана с влиянием разных факторов на скорость выгорания. В резервуарах малого диаметра горячие стенки нагревают жидкость и увеличивают скорость испарения и горения. При увеличении диаметра влияние нагретых стенок снижается, так как стенки контактируют с уменьшающейся частью жидкости. С другой стороны, при увеличении диаметра наблюдается переход горения от ламинарного
53
к турбулентному. При этом уменьшается полнота сгорания, увеличивается количество образующейся сажи. Возрастание степени черноты пламени способствует увеличению теплового потока от пламени. Поверхность жидкости нагревается сильнее, и происходит увеличение скорости испарения и горения.
В резервуарах диаметром более 2 метров скорость выгорания жидкостей практически одинакова (горение со свободной поверхности). В табл. 4 приведены значения скорости выгорания некоторых жидкостей при комнатной температуре.
Т а б л и ц а 4
Скорость выгорания некоторых жидкостей со свободной поверхности при комнатной температуре
Жидкость |
Скорость выгорания, |
|
мм/мин |
Ацетон |
1,4 |
Автомобильный бензин |
1,75 |
Бензол |
3,15 |
Керосин |
1,1 |
Метиловый спирт |
1,2 |
Диэтиловый эфир |
2,93 |
Сильный ветер способствует более эффективному смешиванию паров с воздухом, повышению температуры пламени и увеличению нагрева поверхности жидкости. В результате этого скорость выгорания увеличивается.
По мере снижения уровня жидкости в резервуаре увеличивается расстояние от пламени до поверхности жидкости, поэтому уменьшается приток тепла к жидкости. Скорость выгорания постепенно уменьшается, и при некотором критическом расстоянии поверхности жидкости от борта резервуара горение может прекратиться. Это расстояние называется критической высотой. Для больших резервуаров, в которых критическая высота всегда больше высоты резервуара, самотушение не происходит. Расчеты показывают, что критическая высота резервуара диметром 23м равна 1 км, в то время как его обычная высота равна
12м.
54

ГЛАВА 4
ГОРЕНИЕ ТВЕРДЫХ ВЕЩЕСТВ
Рассмотрим особенности горения твердых материалов, температура плавления или разложения которых превышает 50°C, а также веществ, не имеющих температуры плавления, например, таких как древесина.
По химическому составу твердые горючие материалы делятся на органические и неорганические вещества. Среди горючих органических веществ принято выделять углеводороды, целлюлозосодержащие материалы и элементоорганические соединения. Среди неорганических материалов выделяют металлы и неметаллы (рис. 10).
Твердые горючие материалы
Органические |
|
|
Неорганические |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Углеводороды |
|
|
|
|
|
|
|
Металлы |
|
Неметаллы |
|||
|
|
|
||||
|
|
|
|
|
|
|
Целлюлозосодержащие
Элементоорганические
Рис. 10. Классификация твердых горючих материалов по химическому составу
К горючим твердым углеводородам условно относят природные, искусственные и синтетические полимерные материалы, в состав которых входят С, H, N, O. По структуре углеводороды имеют однородное строение. К ним относятся, например, поли-
55
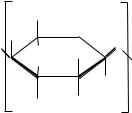
этилен –[CH2 – CH2]n–, глицин (аминокислота) H2N–CH2–COOH
имиллионы других твердых материалов.
Вотдельную подгруппу сведены природные органические материалы, основой которых служит целлюлоза (углевод):
CH2OH |
|
|
H |
O |
|
H |
H |
O |
OH |
|
|
|
|
|
|
|
H |
H |
OH |
n = 3000 - 14000 |
Кним относят полимерные материалы растительного происхождения (древесина, хлопок и др.), которые в отличие от искусственных и синтетических полимеров являются не однородными материалами, а смесью природных полимеров, включая такой полимер, как целлюлоза. В условиях пожара поведение всех растительных материалов одинаковое, и по этой причине их объединяют в одну группу целлюлозосодержащих материалов.
Кэлементорганическим соединениям по данной классификации относят вещества, в состав которых входят такие элементы, как S, P, Si, Cl и металлы. С этих позиций поливинилхлорид является твердым элементоорганическим соединением:
–[CH2 – CH]n–
│
Cl .
В условиях пожара элементорганические соединения образуют особо токсичные вещества, и по этой причине их объединяют в одну группу.
Неорганические твердые горючие вещества – это металлы и неметаллы. Практически все металлы при нормальных условиях окисляются на воздухе. Но к горючим относятся только те из них, которые могут воспламеняться на воздухе от открытого источника зажигания средней мощности и самостоятельно гореть
56
после его удаления. К наиболее горючим относятся щелочные и щелочноземельные металлы.
К неметаллам относят фосфор, мышьяк, кремний, серу. Механизм их воспламенения во многом напоминает горение металлов.
Подавляющее большинство конденсированных органических материалов при нагревании переходят в газовую фазу, после чего осуществляется гомогенное горение продуктов газификации. Этот фазовый переход может осуществляться путем плавления твердого горючего вещества и последующее испарение жидкости. В этом случае процесс воспламенения повторяет процесс подготовки и воспламенения горючих жидкостей. Их горение протекает в гомогенном режиме.
Твердые горючие материалы, которые переходят в парогазовое состояние минуя жидкую фазу за счет сублимации или термической деструкции молекул, горят как в гомогенном, так и в гетерогенный режиме горения.
Общие закономерности воспламенения и горения твердых горючих веществ
Возникновение и развитие горения для твердых горючих материалов имеют много общего с процессами горения газов и жидкостей. Кроме общих черт существует целый ряд особенностей, обусловленных агрегатным состоянием и различиями в строении.
Рассмотрим механизм воспламенения твердого горючего вещества. При контакте вещества с нагретым до высокой температуры источником загорания происходит нагрев поверхностного слоя до температуры фазового перехода (плавления) или термического разложения. Если это материал растительного происхождения, то из него сначала начинает испаряться влага.
Дальнейший нагрев приводит к температуре фазового перехода, происходит плавление материала, затем нагревание расплава до температуры кипения или разложения.
57
Если сразу начинается процесс сублимации или разложения с выделением летучих продуктов, то нарастает количество горючей паровоздушной смеси и ее предварительный нагрев с последующим самовоспламенением и горением паровоздушной смеси.
Если при горении жидкостей тепловой поток, поступающий к поверхности, расходуется только на нагрев и испарение жидкой фазы, то для твердых веществ необходимы затраты на плавление и разложение горючего твердого материала.
Процесс горения большинства твердых горючих материалов начинается с гомогенного режима. Горение характеризуется высокой скоростью распространения, мощными конвективными потоками и излучением.
Время воспламенения зависит от скорости образования над поверхностью материала летучих компонентов в концентрации соответствующей воспламенению. Процесс образования летучих компонентов идет с затратами энергии и для материалов разного состава начинается при различных температурах и протекает с разной интенсивностью. Способность материала сопротивляться нагреву без изменения химической структуры называ-
ется термической стойкостью материала.
Структура диффузионного пламени при горении твердых горючих материалов зависит от геометрических размеров, химического состава материала. Так, при нагревании древесины над его поверхностью образуется воспламеняющаяся смесь горючих газов с воздухом при температуре 150 – 200 оС.
Максимальная температура диффузионного пламени большинства видов твердых горючих веществ достигает 1200 – 1250 оС. Скорость горизонтального распространения пламени по твердым материалам ниже, чем по горючим жидкостям. Она измеряется несколькими сантиметрами в секунду. На рис. 11 представлена структура диффузного пламени на поверхности древесины.
58
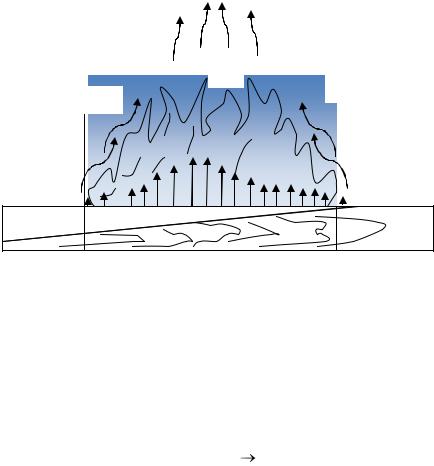
продукты горения
II
воздух
воздух
III |
I |
Рис. 11. Структура диффузного пламени на горизонтальной поверхности твердого горючего материала [6]
Механизм горения углерода
Углерод является важнейшим твердым видом топлива, широко применяемым в котельных, промышленных теплогенерирующих установках и на теплоэлектростанциях. Его горение является гетерогенным процессом и имеет свои особенности.
С(т) + О2(г) СО2(г).
Однако механизм горения более сложен. В зависимости от стадии горения различают два механизма.
На начальной стадии, когда происходит разгорание вещества при относительно невысокой температуре не выше 1000°С, развивается следующая последовательность реакций:
59
Зарождение цепи:
В реакции зарождения цепи, как уже было в механизме горения водорода и СО, участвует вода:
М* + Н2О ОН. + Н. .
Продолжение цепи:
Н. + О2 = ОН. + О: .
Эта реакция также нам знакома по механизмам горения водорода и СО.
Далее активные частицы реагируют на поверхности с углеродом. Углерод представляет собой природный полимер (обозначим его Сх), в котором каждый атом С соединен четырьмя химическими связями с другими атомами С. При взаимодействии с активной частицей две из этих химических связей разрушаются и к атому углерода присоединяется атом кислорода. Об-
разуется так называемый углеродно-кислородный комплекс - час-
тично окисленный полимер углерода:
Сх + ОН = Сх-1СО + Н. .
Этот комплекс может либо разрушаться при температуре горения:
Сх-1СО = Сх-1 + СО↑
либо реагировать с кислородом:
2Сх-1СО + ∙О∙ = 2Сх-1 + СО↑ + СО2↑ .
Углерод может реагировать с кислородом:
Сх + ∙О∙ = Сх-1СО.
60
