
6885
.pdfгенном горении горючее вещество и окислитель находятся в одной фазе, обычно в газовой, например, смесь метана с воздухом.
При гетерогенном горении горючее вещество и окислитель находятся в разных фазах, например, окислитель – газообразное вещество (О2), а восстановитель твердое (уголь, древесина, торф) или жидкое (бензин, мазут, дизельное топливо) вещество. К гетерогенному горению относится тление.
Тлением называют беспламенное горение твердых тел. Так горит кокс – каменный уголь, из которого предвари-
тельно выжгли летучие соединения. Он применяется в металлургии. Так горят пористые материалы (ткани, кошма, пластмассы и др.). При тлении процессы имеют низкую интенсивность и свечение красного типа.
Горение в отсутствии пламени обусловлено условиями теплообмена зоны тления с внешней средой. Устойчивое распространение тления определяется содержанием кислорода в ок-
ружающей среде и разностью температур ∆Т = Ттлен – Тсреда. Чем выше температура окружающей среды, тем выше скорость тле-
ния и выше скорость распространения фронта тления. Стационарный режим тления достигается при равенстве скоростей тепловыделения и теплоотвода.
Отступление. Под системой подразумевают совокупность взаимосвязанных частей, выделенных из окружающей среды и выступающих по отношению к ней как целое. Фаза – гомогенная часть системы, обладающая одинаковыми физическими и химическими свойствами и отделенная от других частей системы поверхностью раздела. Гомогенная или однородная система – система, химический состав и физические свойства которой во всех частях одинаковы. Гетерогенная или неоднородная система – система, состоящая из однородных частей (фаз), разделенных поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Наиболее общим свойством горения гомогенных горючих газовых смесей является проявление в определенных условиях прогрессивного самоускорения процесса – воспламенения.
11
Самовоспламенение, самовозгорание, вынужденное зажигание
Горение возникает при определенных (критических) условиях (температура, размеры реакционного сосуда и др.) из-за того, что тепловыделение в ходе реакции превышает теплоотдачу в окружающую среду. В зависимости от начальных условий,
вкоторых находится горючая система, и природы первоначального теплового импульса различают три вида возникновения горения: самовоспламенение, самовозгорание, вынужденное зажигание.
Самовоспламенение – явление быстрого нарастания скорости окислительно-восстановительной реакции, приводящее при определенных внешних условиях к воспламенению горючего вещества без соприкосновения с пламенем или раскаленным телом. Условиями самовоспламенения могут быть резкое повышение температуры или давления, а также введение смеси в нагретый сосуд. Необходимо, чтобы при этом смесь находилась в концентрационных пределах воспламенения и была достигнута температура самовоспламенения, характерная для данной горючей смеси и конструкции конкретного устройства. Самовоспламенение характерно и для гомогенных и для гетерогенных смесей. Отличие гомогенного от гетерогенного самовоспламенения
втом, что гомогенный это чисто химический процесс, а гетерогенный состоит из двух стадий: физической и химической. Отличительная особенность самовоспламенения является загорание всей смеси сразу. В этом его отличие от воспламенения. Для того чтобы самовоспламенение произошло, требуется достижение определенной температуры – температуры самовоспламенения.
Температура самовоспламенения — это наименьшая температура горючего вещества, при достижении которой происходит резкое увеличение скорости экзотермической реакции, приводящее к появлению пламенного горения.
12
Температура самовоспламенения непостоянна, она зависит от состава горючей смеси, давления, начальной температуры, концентрации горючего материала. Факторы, увеличивающие интенсивность тепловыделения горючей системы, приводят к снижению температуры самовоспламенения, а факторы, увеличивающие теплоотдачу горючей системы, приводят к увеличению температуры самовоспламенения.
Температура самовоспламенения горючих веществ разнообразна. У одних она превышает 500°С у других находится в пределах температуры окружающей среды и условно еѐ можно принять равной от 0 до 50°С.
Например, желтый фосфор при температуре 15°С окисляется кислородом воздуха и загорается. Вещества, способные самовоспламеняться без нагрева, представляют большую пожарную опасность и называются самовозгорающимися, а процесс самонагревания их до стадии горения определяют термином самовозгорание. К самовозгорающимся относят вещества трех групп:
-группа 1 включает вещества, самовозгорающиеся при окислении кислородом воздуха. Это, прежде всего, растительные масла, животные жиры, бурый и каменный угли, сульфиды железа, желтый фосфор и др.;
-группа 2 включает вещества, самовозгорающиеся в результате реакции с водой. К ним относятся такие металлы, как калий, натрий и такие соединения, как карбид кальция, карбиды щелочных металлов, фосфористые кальций и натрий, негашеная известь и др.;
-группа 3 включает вещества, самовозгорающиеся при смешивании друг с другом (ацетилен, водород, метан и этилен в смеси с хлором; перманганат калия, смешанный с глицерином или этиленгликолем; скипидар в хлоре и др.).
Самовозгорание в отличие от самовоспламенения представляет собой процесс горения, вызванный происходящими в веществе экзотермическими химическими, физико-химическими
13
или биологическими явлениями. Самовозгорание возникает без соприкосновения с открытым пламенем и притока тепла извне. Процесс самовозгорания ускоряется, когда накопление тепла и, следовательно, нарастание температуры, происходящее в результате процесса окисления, превышают рассеивание тепла в окружающую среду.
Накопление тепла вследствие протекания экзотермических реакций происходит при определѐнных условиях (высокая удельная поверхность дисперсных материалов, слабая теплоотдача). Вследствие самонагревания (повышения температуры материала) происходит самоускорение таких реакций.
Есть материалы, которые при известных условиях могут самовоспламеняться и самовозгораться. Среди материалов, используемых на строительстве, особенно подвержены самовозгоранию волокнистые: пакля, тряпки, опилки, пропитанные различными маслами.
Начало самовозгорания характеризуется температурой самовозгорания (Tсв), представляющей собой минимальную в условиях опыта температуру, при которой обнаруживается тепловыделение. При достижении в процессе самонагревания температуры Tсв. возникает либо тление, либо пламенное горение.
Вынужденное зажигание обусловлено возникновением горения горючей смеси в одной точке в результате действия источника зажигания (искры, нагретого тела, открытого пламени) с дальнейшим воспламенением всей системы.
В зависимости от природы источника тепла различают следующие виды источников зажигания:
-экзотермические химические реакции;
-тепловые проявления электрической и механической
энергии;
-открытое пламя.
Общим для всех процессов зажигания служат следующие признаки:
14
-температура системы превышает некоторое критическое значение;
-тепловыделение в горючей системе за счет химической реакции окисления превышает теплоотдачу из системы в окружающее пространство;
-переходу от медленной реакции окисления к горению предшествует период индукции. Период индукции в горючей системе – это подготовительный процессы к началу горения
Если горючее вещество находится в конденсированном состоянии (твердое или жидкое), то за этот период индукции происходит:
-нагрев горючей системы;
-окисление газообразных продуктов с выделением тепла;
-самонагревание горючей системы;
-возникновение горения.
Один и тот же вид горючего может гореть контролируемым путем, например, природный газ в горелке кухонной плиты, но может его горение сопровождаться взрывом, если помещение заполнено смесью природного газа с воздухом в определенном соотношении. Достаточно искры, чтобы произошел так называемый цепной взрыв.
Взрыв
Взрыв – быстро протекающий процесс физического или химического характера, сопровождающийся выделением большого количества энергии в ограниченном объеме за короткий промежуток времени.
В подавляющем большинстве случаев взрывы, с которыми приходится иметь дело на практике, имеют химическую природу превращения веществ. К ним относятся взрывы, применяемые в производственной практике или в военных целях и, разумеется, происходят взрывы аварийного характера, например, взрывы метана газа в шахтах.
15

Примерами взрывов физического характера могут служить взрывы сжатых газов или взрывы, связанные с эксплуатацией паровых котлов.
Взрывы, связанные с химическим превращением взрывчатых веществ (ВВ), являются разновидностью реакций горения. Такие вещества уже содержат в своем составе и окислитель ( NO2), и восстановитель ( СН группы). Например, взрыв кристаллического 2,4,6-тринитротолуола (тротила) сопровождается повышением температуры и давления образовавшихся газообразных продуктов реакции:
 NO2
NO2
O2N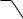

 CH3
CH3  32 N2 + 52 H2O + 72 CO + 72 C ;
32 N2 + 52 H2O + 72 CO + 72 C ; 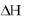 NO2
NO2
Энергетический потенциал (∆Н) взрыва тротила составляет 4520 кДж/кг.
Аналогичная картина наблюдается при взрыве жидких ВВ, например, тринитроглицерина:
H2CONO2 |
|
|
|
|
|
|
|
|
||
|
|
|
3 |
|
5 |
|
1 |
|
|
|
HCONO2 |
N2 + |
H2O + 3CO2 + |
O2 |
; ∆H. |
||||||
2 |
2 |
2 |
||||||||
|
|
|
|
|
||||||
H2CONO2
Горение при взрыве сопровождается высокой скоростью энерговыделения и распространения пламени в соответствующей среде. Например, для твердых ВВ таких, как тротил и жидких таких, как тринитроглицерин скорость распространения взрывной волны лежит в пределах 2 – 9 тыс. м/с.
Заметим, что при взрыве горючей газовой смеси скорость распространения взрывной волны лишь в несколько раз превосходит скорость звука и составляет около 1 тыс. м/с.
16
Специалисты по взрывному делу обратили внимание на то, что энергетический потенциал (суммарное выделение энергии при взрыве) газовых смесей, таких как метан – воздух, водород – воздух намного превосходит традиционные взрывчатые вещества. Например, энтальпия сгорания 1 кг водорода в стехиометрической смеси с кислородом воздуха составляет 120 МДж/кг, в то время как такой же показатель для тротила равен, как было сказано выше, всего 4520 кДж/кг. Известно, что при определении энергетического потенциала ВВ учитывается масса и горючей и окислительной части взрывчатого вещества. Для газовой смеси учитывается энергетический потенциал только по горючему веществу. Это обстоятельство использовано при создании боеприпасов объемного взрыва («вакуумных бомб»). В таких бомбах сначала подрывается вспомогательный заряд, разрушая корпус, содержащий, например, такое горючее вещество, как этиленоксид. Горючее вещество распыляется на значительное пространство, смешиваясь с воздухом и заполняя негерметизированные полости и укрытия. Затем эта смесь, близкая к стехиометрическому составу, подрывается специальным детонатором, установленным в бомбе. Происходит громадный объемный взрыв большой разрушительной силы, превосходящий взрыв ВВ в несколько раз.
Различают два вида взрывного горения: дефлаграционное и детонационное горение.
Дефлаграционное горение осуществляется посредством передачи энергии в форме теплоты в соседние с зоной горения участки ВВ. Скорость развития дефлаграционного горения зависит главным образом от теплоемкости и теплопроводности горючего материала, по которому распространяется горение.
Детонационное горение осуществляется посредством скачкообразного изменения давления, температуры, плотности ВВ в узкой зоне, где происходит горение. Эта узкая зона – детонационная волна распространяется с громадной скоростью и вызывает самовоспламенение ВВ.
17
Детонационная волна – один из видов ударной волны, распространение которой сопровождается тепловыделением благодаря реакциям во фронте. Это волна поджигает следующую порцию газа. Главный признак детонационной волны – огромный перепад давлений перед фронтом и позади его. Большое давление перед фронтом сильно сжимает газовую смесь и образует высоконагретые продукты, которые самовоспламеняются.
Кинетическая и диффузионная области горения
Для создания теоретических основ конкретного процесса горения важно понять, какой процесс – физический или химический – является лимитирующим, самым медленным, определяющим скорость всего процесса в целом. Для ускорения всего процесса горения нужно ускорять, прежде всего, лимитирующий процесс.
Область горения, в которой время сгорания зависит только от скорости химической реакции между кислородом и горючим, называется кинетической. В кинетической области осуществляется, например, тление древесного угля или древесины. Так как тление происходит при низкой температуре, скорость реакции настолько мала, что скорость диффузии кислорода к поверхности обычно опережает скорость взаимодействия кислорода. В данном примере лимитирующей стадией является химическая реакция, так как она самая медленная.
Область горения, в которой скорость процесса зависит только от времени, необходимого для возникновения физического контакта кислорода и горючего или от скорости другого физического процесса, называется диффузионной.
Горение жидкого топлива происходит обычно в диффузионной области. При горении жидкого топлива лимитирует скорость испарения (а горит, как сказано выше, только испарившиеся вещество). Если требуется ускорить весь процесс горения, то нужно создать условия для лучшего испарения.
18

Для гомогенных процессов лимитирующая стадия зависит от общего давления смеси. При высоком давлении частота столкновений реагирующих частиц очень большая, поэтому лимитировать может скорость химической реакции. В этом случае горение происходит в кинетической области.
Вгазовых смесях процесс может протекать также в диффузионной области, если общее давление низкое, так как самой медленной стадией будет взаимная диффузия и столкновение реагирующих частиц. Между этими крайними случаями есть область промежуточных давлений, при которых важны оба процесса: и химический, и физический.
Вдиффузионной области происходит также горение газа, выходящего из трубы. В этих случаях смесь паров и газов с воздухом образуется во время горения в результате диффузии кислорода к молекулам горючего.
При интенсивном высокотемпературном горении твердого топлива обычно лимитирует диффузия кислорода к поверхности топлива и отвод продуктов от поверхности. Когда горение антрацита, кокса или древесного угля происходит при повышенных температурах, тогда скорость диффузии кислорода к поверхности отстает от скорости химической реакции.
Теория теплового воспламенения
Часто самовоспламенение газовых смесей горючего и окислителя при повышении температуры приводит к взрыву. Теория теплового воспламенения или взрыва разработана русским ученым, лауреатом Нобелевской премии, академиком Н.Н.Семеновым.
Рассмотрим тепловое воспламенение на примере элементарной бимолекулярной реакции:
А + В продукты реакции; Н [кДж]. Скорость реакции:
|
Е |
|
|
= k CАСВ = k0 е RT CАСВ . |
(1.1) |
||
19 |
|
|
|

Введем понятие скорость тепловыделения – количество энергии в форме теплоты, которое выделяется в единицу времени в единице объема реактора. Скорость тепловыделения Q1 имеет размерность [кДж/м3∙с]:
Е |
|
Q1 = Н = Н k0 е RT CАСВ . |
(1.2) |
Воспользуемся уравнением идеального газа рV = nRT и мольными долями реагентов NА + NВ = 1 для преобразования уравнения
(1.2).
pi V = ni RT или pi = |
ni |
|
RT или pi = СiRT, отсюда |
|
||
V |
|
|||||
|
|
|
|
|
||
|
|
|
|
рi |
|
|
Сi = |
|
|
. |
(1.3) |
||
|
RT |
|||||
Парциальные давления реагентов рА и рВ выразим через |
||||||
общее давление системы р = рА + рВ: |
|
|||||
рА = рNА |
(1.4) |
|||||
рВ = р (1 – NА) . |
(1.5) |
|||||
Выразим CА и СВ через общее давление и мольные доли реагентов:
CА = |
|
|
p |
N A |
, CB = |
p |
(1 N A ) |
|
|
|||
|
|
|
|
|
|
|||||||
|
RT |
|
RT |
|
|
|||||||
и подставим в уравнение (2): |
|
|
|
|
|
|
|
|||||
|
|
|
Hk0 |
|
|
|
|
Е |
|
|
||
|
|
|
|
|
|
|
||||||
Q1 = |
|
|
NA (1 – NA)р2 е |
RT |
. |
(1.6) |
||||||
|
(RT )2 |
|||||||||||
|
|
|
|
|
|
|
|
|
||||
Обозначим выражение |
|
|
Hk0 |
= D. |
|
|
|
|
|
|
||
|
|
(RT )2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Е |
|
|
|
|
||||||||||
По сравнению экспоненциальным выражением е |
RT зна- |
|||||||||||
чение D можно принять за постоянную величину, т.к. при изменении температуры D изменяется незначительно по сравнению с
Е
экспоненциальным множителем е RT .
20
