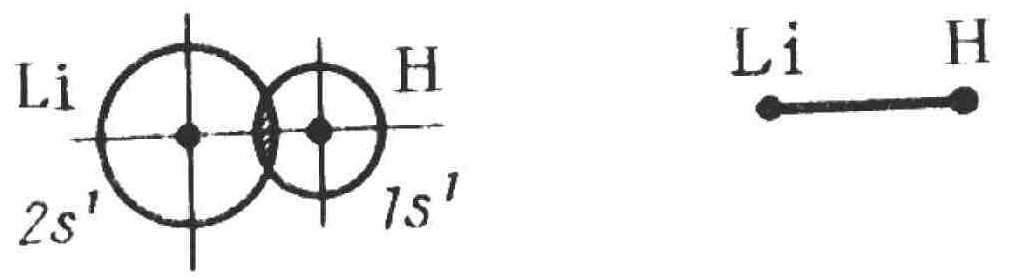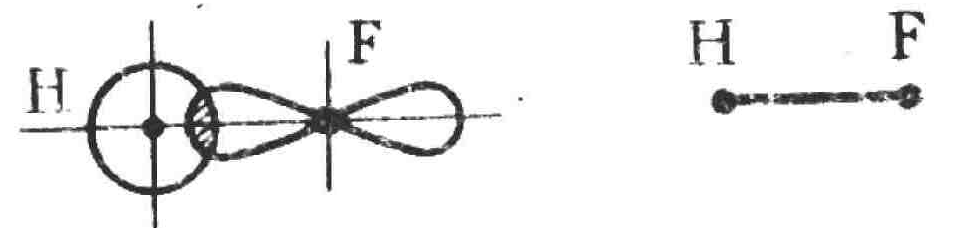- •Основные понятия и законы химии
- •Структура периодической системы элементов
- •Изменение свойств элементов и их соединений в периодах и главных подгруппах
- •Определение степени окисления
- •Расположение электронов по энергетическим уровням
- •Распределение электронов в атоме
- •Химическая связь
- •Гибридизация
- •Молекулы водородных соединений элементов 2-го периода
- •Относительные электроотрицательности элементов
- •Ряд стандартных электродных потенциалов
- •Разложение нитратов при нагревании
- •Тривиальные названия химических соединений
- •Окраска пламени газовой горелки при внесении анализируемого вещества на предварительно прокаленной палочке или проволочке
- •Качественные реакции на катионы и анионы
- •Квантовые числа
- •Литература
- •Ядро атома. Изотопы
- •Литература
Химическая связь
ковалентная это химическая связь, возникающая в результате образования общих электронных пар между ядрами взаимодействующих атомов.
Гибридизация
ГИБРИДИЗАЦИЯ это явление взаимодействия между собой молекулярных орбиталей, близких по энергии и имеющих общие элементы симметрии, с образованием гибридных орбиталей с более низкой энергией.
Чем полнее в пространстве перекрываются друг с другом электронные облака, участвующие в химической связи, тем меньшим запасом энергии обладают электроны, находящиеся в области перекрывания и осуществляющие связь, и тем прочнее химическая связь между этими атомами
Иногда связь между атомами прочнее, чем этого можно было ожидать на основании расчета. Предполагается, что атомная орбиталь принимает форму, позволяющую ей более полно перекрываться с орбиталью соседнего атома. Изменить свою форму атомная орбиталь может, лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. В результате комбинации различных орбиталей (s, p, d) возникают новые атомные орбитали промежуточной формы, которые называются гибридными.
Перестройка различных атомных орбиталей в новые орбитали, усредненные по форме называется гибридизацией.
Число атомных орбиталей, несмотря на их видоизменение сохраняется.
Фролов В. В. Химия: Учеб. пособие для машиностроит. спец. вузов. - 3-е изд., перераб. и доп. - М.: Высш. шк., 1986. - 543 с., ил.
С. 79
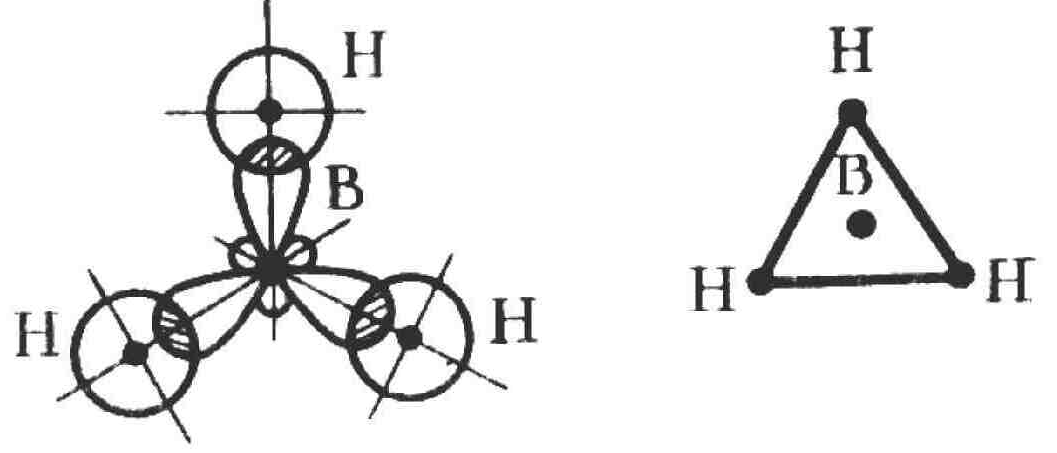
Молекулы водородных соединений элементов 2-го периода
Соединение |
Строение |
Тип |
LiH
|
|
Линейная |
BeH2 |
|
Линейная трех центровая |
BH3 |
|
Плоская треугольная
|
CH4 |
|
Объемная тетраэдрическая
|
NH3 |
|
Объемная тригональная
|
Соединение |
Строение |
Тип |
H2O |
|
Плоская угловая
|
HF |
|
Линейная |
Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. – 4-е изд., испр. – М.: Высш. шк., Изд. центр «Академия», 2001. – 743 с., ил.
Стр. 82 – …

КИСЛОТЫ
-
Кислота
Сила кислоты
Название соли
HF - плавиковая (фтористо-водородная)
средней силы
фторид
HCl - соляная (хлористо-водородная)
сильная
хлорид
HClO - хлорноватистая
очень слабая
гипохлорит
HClO2 - хлористая
слабая
хлорит
HClO3 - хлорноватая
сильная
хлорат
HClO4 - хлорная
очень сильная
перхлорат (тетраоксохлорат)
HBr - бромисто-водородная
сильная
бромид
HBrO - бромноватистая
очень слабая*
гипобромит
HBrO2 - бромистая
слабая**
бромит
HBrO3 - бромноватая
сильная
бромат
HBrO4 - бромная
очень сильная
пербромат (тетраоксобромат)
HI - иодисто-водородная
сильная
иодид
HIO - иодноватистая
очень слабая*
гипоиодит
HIO2 - иодистая
слабая**
иодит
HIO3 - иодноватая
сильная
иодат
HIO4 - иодная
очень сильная
периодат (тетраоксоиодат)
H5IO6 - ортопериодная
очень сильная
ортопериодат
HF HCl HBr HI снижение устойчивости; увеличение силы кислоты
HClO HBrO HIO рост относительной устойчивости
HClO3 HBrO3 HIO3 ослабление кислотных свойств
* - на свету и при нагревании разлагается
** - BrO2- и IO2- - неустойчивы
HNO2 - азотистая
слабая
нитрит
HNO3 - азотная
сильная
нитрат
H2S - сероводородная
слабая
сульфид
H2SO3 - сернистая
слабая; неустойчивая
сульфит
H2SO4 - серная
сильная
сульфат
H3PO4 - ортофосфорная
средней силы
фосфат
H2SiO3 - кремниевая
слабая; нерастворимая
силикат
H2MnO4 - марганцовистая
сильная
манганат
HMnO4 - марганцовая
очень сильная
перманганат
Марганцевые кислоты очень нестойкие. HMnO4 может существовать в подкисленном растворе, а H2MnO4 в растворе сразу же диспропорционирует:
3 H2MnO4 MnO2 + 2 HMnO4 + 2H2O
H2CrO4 - хромовая
сильная
хромат
H2Cr2O7 - двухромовая
сильная
бихромат
H2CO3 - угольная
слабая; неустойчивая
карбонат
-
Индикатор
Цвет индикатора в среде
кислой
щелочной
нейтральной
Лакмус
Красный
Синий
Фиолетовый
Фенолфталеин
Бесцветный
Малиновый
Бесцветный
Метиловый оранжевый
Розовый
Желтый
Оранжевый
НЕЛЬЗЯ ВЛИВАТЬ ВОДУ В КОНЦЕНТРИРОВАННУЮ серную КИСЛОТУ !!!
-
Катионы
Анионы
OH-
F-
Cl-
Br-
I-
S-2
SO3-2
SO4-2
NO3-
PO4-3
CO3-2
SiO3-2
CH3COOH-
CrO4-2
NH4+
-
р
р
р
р
-
р
р
р
р
р
-
р
р
Li+
р
р
р
р
р
р
р
р
н
р
р
р
р
Na+, K+
р
р
р
р
р
р
р
р
р
р
р
р
р
р
Mg+2
н
н
р
р
р
р
н
р
р
н
н
н
р
р
Ca+2
м (р)
н
р
р
р
м
н
м
р
н
н
н
р
м
Ba+2
р
м
р
р
р
н
н
н
р
н
н
н
р
н
Al+3
н
м
р
р
р
-
-
р
р
н
-
н
м
-
Cr+3
н
н
р
р
р
-
-
р
р
н
-
н
р
р
Zn+2
н
м
р
р
р
н
н
р
р
н
н
н
р
н
Mn+2
н
м
р
р
р
н
н
р
р
н
н
н
р
н
Co+2, Ni+2
н
р
р
р
р
н
н
р
р
н
н
н
р
Fe+2
н
н
р
р
р
н
н
р
р
н
н
н
р
-
Fe+3
н
н
р
р
р
-
-
р
р
н
н
н
р
-
Cd+2
н
р
р
р
р
н
н
р
р
н
н
н
р
Hg+2
-
-
р
м
н
н
н
р
р
н
н
-
р
н
Cu+2
н
н
р
р
р
н
н
р
р
н
н
н
р
р
Ag+
н
р
н
н
н
н
н
м
р
н
н
н
р
н
Sn+2
н
р
р
р
р
н
-
р
-
н
-
-
р
-
Pb+2
н
н
м
м
н
н
н
н
р
н
н
н
р
н
Bi+3
н
-
-
-
н
н
-
р
н
н
-
-
н
Н+
р
р
р
р
р
р
р
р
р
р
н
р
р