
- •Химическая термодинамика, равновесие и кинетика химических реакций
- •Первый закон термодинамики – это закон сохранения энергии, согласно которому энергия ниоткуда не берется и никуда не девается, а только переходит из одной формы в другую.
- •Возможно несколько вариантов изменения сумм энтальпий образования и энтропий веществ в ходе процесса.
- •Химическое равновесие
- •Химическая кинетика
- •Факторы, влияющие на скорость химической реакции
- •Обратимые и необратимые реакции
- •Условия обратимости химических реакций
- •Энтропия оказалась подвержена манипуляциям
- •Катализ
Химическая кинетика
В результате химической реакции исчезают одни и образуются другие вещества. В процессе реакции изменяются количества вещества: как реагентов (исходных веществ), так и продуктов (конечных веществ). Скорость этого изменения называется скоростью химической реакции. Химическая кинетика – учение о скоростях и механизмах химических реакций. По числу взаимодействующих в реакции молекул различают реакции мономолекулярные, бимолекулярные и тримолекулярные. Например, диссоциация молекулярного йода на атомы: I2 = 2I – мономолекулярная реакция.
Взаимодействие йода с водородом: I2 + Н2 = 2HI – бимолекулярная реакция.
Закон действующих масс для химических реакций разной молекулярности записывается по-разному: для мономолекулярных реакций А = В + С,
 =
kcA,
=
kcA,
где k – константа скорости реакции;
для
бимолекулярной реакции А
+ В = С,
![]() =
kcAcВ
=
kcAcВ
и для тримолекулярной реакции 2А + В = С, = kc2AcВ.
Таким образом, скорость химической реакции можно описать уравнением
r
=
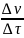 , (1)
, (1)
где
r
– скорость реакции (от англ. rate
— скорость
процесса, в отличие от ранее используемого
обозначения для скорости реакции
–
velocity
– скорость перемещения),
(прописная
греч. дельта)
– синоним слов «конечное изменение»,
![]() (греч.
ню)
– количество (моль) вещества-реагента
или вещества-продукта,
(греч.
ню)
– количество (моль) вещества-реагента
или вещества-продукта,
![]() (греч.
тау)
– время (с), за которое произошло данное
изменение.
(греч.
тау)
– время (с), за которое произошло данное
изменение.
Описываемая уравнением (1) скорость реакции зависит от количеств взятых веществ-реагентов. Скорость химической реакции — это изменение количества вещества какого-либо участника реакции в единицу времени в единице реакционного пространства.
В гомогенной системе реакция происходит во всем объеме V системы (в газовой фазе или растворе). В такой реакции единицей реакционного пространства является единица объема, и если этот объем не изменяется в процессе реакции, то уравнение имеет вид:
r
=
±
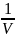 ∙
= ±
∙
= ±
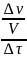 = ±
= ±
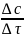 , (2)
, (2)
где с — молярная концентрация вещества (моль/л).
Скорость реакции — изменение концентрации вещества в единицу времени.
В гетерогенной системе (например, при горении твердого тела в газе или при взаимодействии металла с кислотой) реакция происходит на границе раздела между компонентами. Если площадь этой границы S, то уравнение скорости имеет вид:
r
=
±
 ∙
, (3)
∙
, (3)
Очевидно, что при таком определении (см. уравнения (2) и (3)) величина скорости реакции не зависит от объема в гомогенной системе и от площади соприкосновения реагентов (степени измельчения) в гетерогенной системе.
Факторы, влияющие на скорость химической реакции
Увеличивают скорость |
Уменьшают скорость |
Наличие химически активных реагентов |
Наличие химически неактивных реагентов |
Повышение концентрации реагентов |
Понижение концентрации реагентов |
Увеличение поверхности твердых и жидких реагентов |
Уменьшение поверхности твердых и жидких реагентов |
Повышение температуры |
Понижение температуры |
Присутствие катализатора |
Присутствие ингибитора |
Влияние природы реагентов
При замене серной кислоты (сильной кислоты) на уксусную (слабую кислоту) скорость реакции кислоты с металлом во всех случаях существенно замедляется. Можно сделать вывод, что на скорость реакции металла с кислотой влияет природа обоих реагентов – как металла, так и кислоты.
Влияние концентраций реагентов
Чем выше концентрация вещества, тем больше частиц в единице объема, тем чаще они сталкиваются. Количественно это выражается так называемым законом действующих масс – скорость реакции пропорциональна концентрациям реагентов в некоторых степенях. Например, для следующих ниже уравнений реакций выражения скорости такие: А = С, r = kсA;
А + В = С, А + 2В = С, |
r = kсAсВ; r = kсAсВсB = kсAсВ2. |
Величина k – коэффициент пропорциональности – называется константой скорости реакции и не зависит от концентраций. Численно этот коэффициент равен скорости реакции, если произведение концентраций реагентов равно 1. Когда сравнивают скорости разных реакций, то сравнивают именно их константы скоростей.
Скорость реакций, протекающих в несколько последовательных стадий, определяется самой медленной из этих стадий. Вспомним арабскую поговорку: «Караван идет со скоростью самого медленного верблюда». Например, реакция
2Fe2+ + H2O2 = 2FeOH2+ протекает по следующим стадиям:
1) Fe2+ + H2O2 = FeOH2+ + OH•, k1 = 60 л/(моль•с);
2) OH• + Fe2+ = FeOH2+, k2 = 60 000 л/(моль•с).
Более медленная стадия – первая. Поэтому уравнение скорости данной реакции – r = k1c(Fe2+)c(H2O2), a не r = kc2(Fe2+)c(H2O2).
Влияние температуры. Энергия активации
Влияние температуры на протекание химической реакции двояко. Во-первых, температура может влиять на состав продуктов, может изменить не только ее скорость, но и ее путь, т.е. привести к другим продуктам. Во-вторых, подавляющее большинство реакций ускоряются при увеличении температуры.
Из физики известно, что скорость движения молекул газа пропорциональна корню квадратному из температуры:
 /
/ =
=

Повышение
температуры, например от 250 С
до 350 С,
вызовет увеличение скорости движения
молекул и, следовательно, числа
столкновений в
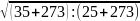 = 1,02 раза. А что говорит правило Вант-Гоффа?
= 1,02 раза. А что говорит правило Вант-Гоффа?
Действительная роль повышения температуры в ускорении реакций заключается в том, что с повышением температуры быстро, экспоненциально, растет число так называемых «активных» молекул, т.е. молекул, обладающих энергией, большей, чем энергия активации. При повышении температуры на десять градусов скорость увеличивается в число раз, равное температурному коэффициенту скорости γ:
γ =vT+10/vT.
При повышении температуры от T до T1 отношение скоростей реакций vT' и vT' +10 равно температурному коэффициенту скорости в степени (T' – T)/10:
![]()
Для
многих гомогенных реакций температурный
коэффициент скорости равен 2![]() 4
(правило Вант-Гоффа).
4
(правило Вант-Гоффа).
В ходе химической реакции происходит перегруппировка атомов, сопровождающаяся разрывом химических связей в исходных веществах и образованием связей в продуктах реакции. При столкновении реагирующих молекул сначала образуется так называемый активированный комплекс, в котором происходит перераспределение электронной плотности, и лишь потом получается конечный продукт реакции:
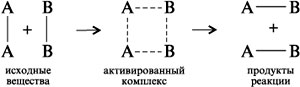
Энергия активации — это разность между средней энергией молекул при данной температуре и той энергией, которой они должны обладать, чтобы вступить в химическую реакцию.
Более точно и более универсально зависимость константы скорости реакции от температуры выражена уравнением Аррениуса (1889):

Множитель A связан с частотой столкновений частиц и их ориентацией при столкновениях; Ea – энергия активации данной химической реакции.
Если бы не существовало активационного барьера, то и наш мир не существовал бы, т.к. все возможные реакции уже прошли бы. Чем больше энергия активации, тем сильнее скорость реакции зависит от температуры.
