
5.3. Гальванические элементы
Комбинация двух электродов образует гальванический элемент или гальваническую ячейку.
|
|
Рис. 5.6. Гальванический элемент без жидкостного соединения. |
Рис. 5.7 а. Проточный вариант жидкостного соединения. |
Рис. 5.7 б. Солевой мостик. |
Например, сочетание водородного и хлорсеребряного электродов дает наиболее простой элемент без жидкостного соединения, т.е. элемент с общим электролитом (рис. 5.6).
Pt, H2 | HCl | AgCl, Ag, Pt
Если два электрода, левый (L) и правый (R), помещены в два разных электролита, то образуется элемент с жидкостным соединением.
Варианты жидкостного соединения для так называемого концентрационного элемента (электролиты у левого и правого электродов отличаются только концентрацией, в данном случае в единицах моляльности) показаны на рис. 5.7.
Pt, H2 | HCl(mL) | HCl(mR) |H2, Ag, Pt
Другим способом жидкостного соединения полуэлементов является так называемый солевой мостик (рис. 5.7), приготовленный растворением KCl в водорастворимом желе. Ток в мостике определяется высокой концентрацией переносимых ионов K+ и Cl¯. Считается, что дополнительные потенциалы "солевой мостик" ‑ раствор взаимно сокращаются. Причины и механизм успешного действия солевого мостика к настоящему времени до конца не выяснены.
Диффузионные контакты двух растворов посредством жидкостного соединения вносят элементы неравновесности, осложняющие термодинамический анализ.
Жидкостное соединение можно исключить, сконструировав двойной элемент (два одинаковых элемента - навстречу).
Pt, H2 | HCl(mL)|AgCl, Ag...Ag, AgCl | HCl(mR) | H2, Pt
Такое исключение жидкостного соединения между полуэлементами в формуле элемента обозначается значком ||.
|
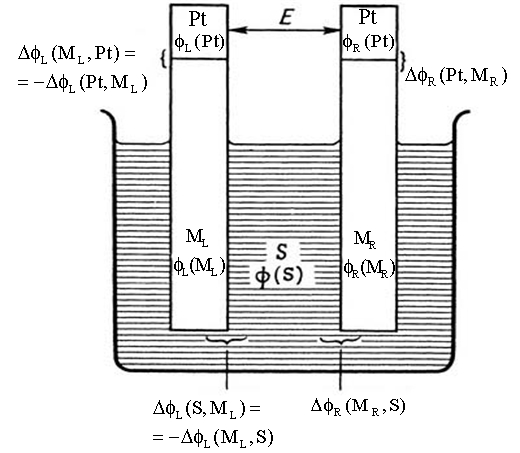
Разность потенциалов гальванического элемента, измеренная при равновесии (ток не протекает) и между платиновыми клеммами, называется электродвижущей силой (ЭДС). Кроме аббревиатуры используют обозначения э.д.с. или E. Математическая аддитивность потенциалов определяет результирующую разность потенциалов как сумму межфазных. |
Рис. 5.8. Определение э.д.с. элемента по разностям потенциалов. |
Производя суммирование, начиная с правой платиновой клеммы, получаем:
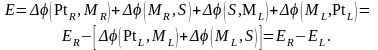 (5.15)
(5.15)
1) Э.д.с. выражается в виде разности электродных потенциалов (5.16), которые кроме собственно межфазной разности потенциалов, включают контактную разность потенциала платиновой клеммы, если электрод не платиновый.
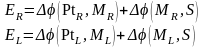 (5.16)
(5.16)
Отметим, что обозначения в скобках совмещают и названия веществ электродов, раствора и их агрегатное состояние.
2) Принимается соглашение (обязательное для последующего изложения): знак э.д.с. всегда относится к разности потенциалов ER – EL правого и
левого электродов в том виде, в котором записан гальванический элемент (при желательной, но не обязательно аналогичной схеме его монтажа на подставке).
Общая запись Pt | ML | S | MR | Pt |
: |
Пример Pt
| H2( |
||||
L |
R |
|
L |
R |
||
Примечания. Напомним, что межфазная граница в обозначении гальванического элемента, как правило, отмечается вертикальной чертой. Иногда внутреннюю межфазную границу, как в записи хлорсеребряного электрода, отмечают запятой. Запятой может быть отмечена и контактная платиновая клемма. Дополнительно в скобках конкретизируется: , в единицах атм., давление для газового электрода, а для раствора – концентрация, обычно в моляльностях m.
Максимально
положительная ЭДС будет наблюдаться в
том случае, если потребляющая электроны
восстановительная реакция
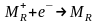 ,
создающая их дефицит и положительный
потенциал на правом электроде, сочетается
с окислительным высвобождением электронов
,
создающая их дефицит и положительный
потенциал на правом электроде, сочетается
с окислительным высвобождением электронов
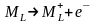 ,
дающим отрицательный потенциал на левом
электроде.
,
дающим отрицательный потенциал на левом
электроде.
Сложение протекающих слева направо полуреакций естественно даст реакцию того же направления и соответственно положительную ЭДС.
E >
0,
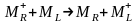 .
(5.17+)
.
(5.17+)
Обратное протекание указанных процессов даёт отрицательную ЭДС
E < 0,
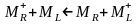 .
(5.17¯)
.
(5.17¯)
Правило определения направления спонтанной ОВР L + R+ = L+ + R по э.д.с. соответствующего гальванического элемента L | L+ | R+ | R при использовании потенциалов восстановительных полуреакций. (Веществам правого и левого электродов соответствуют символы R и L.):
Записываем полуреакции на электродах в восстановительной форме с табличными значениями потенциалов (две первые строки). При этом к правому электроду относится та из них, которая по направлению совпадает с направлением анализируемой ОВР (вторая строка). Относимая к левому электроду сопряженная окислительная полуреакция, исходя из записанной восстановительной её формы, читается справа налево.
Для получения анализируемой реакции (третья и четвертая строки слева) производим вычитание реагентов и продуктов полуреакции левого электрода из полуреакции правого, а также соответствующее вычитание потенциалов для получения э.д.с. (третья строка справа).
Реакция протекает в направлении, указываемом знаком э.д.с. (четвертая строка справа).
– |
L+ + e– = L |
EL |
R+ + e– = R |
ER |
|
|
R+ – L+ = R – L |
E = ER - EL |
|
R+ + L = R + L+ |
E > 0 – вправо; E < 0 – влево. |
Более наглядный способ реализации правила (с использованием ранее введенного значка сопряжения полуреакций) предусматривает при записи суммарной реакции сложение реагентов по «хвостам» стрелок и продуктов - по «остриям».
+ |
L+ + e– R+ + e– |
|
L EL R ER |
|
L + R+ = L++ R E = ER - EL |
||
Пример - реакция коррозии железа в кислотных условиях
Fe + 2 H+Cl¯ (aq) + 1/2 O2 = Fe2+Cl¯2(aq) + H2O
L: 1/2 Fe2+ + e– ← 1/2 Fe -0,44 В
R: H+ + e– + 1/4 O2 → 1/2 H2O 1,229 В
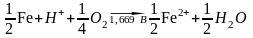 E
= 1,229 – (-0,44)
=1,669 В
E
= 1,229 – (-0,44)
=1,669 В
Положительная и значительная по величине ЭДС подтверждает активную роль этой реакции в коррозии железа.



 )
| HCl(m)
|AgCl, Ag | Pt
)
| HCl(m)
|AgCl, Ag | Pt