
- •Лекция №10 Физика атома
- •Вопрос 1. Развитие взглядов на строение вещества. Опыт э.Резерфорда по рассеянию - частиц
- •Вопрос 2. Опыт э. Резерфорда по рассеянию а – частиц
- •Вопрос 3. Линейчатый спектр атома водорода
- •Вопрос 4. Модель водородоподобного атома по Бору
- •Постулаты Бора
- •Уровни энергии в атоме
- •Линейчатые спектры
- •Рентгеновское излучение
Вопрос 3. Линейчатый спектр атома водорода
Важную роль в развитии планетарной модели атома сыграли эмпирические закономерности, полученные для линейчатого спектра атома водорода.
Иоганн
Якоб Бальмер Швейцарский физик и математик. Родился в Лозанне. Обнаружил закономерность в спектральных линиях атома водорода, показав (1885), что длины волн линий видимой части спектра атома водорода связаны между собой простой зависимостью (формула Бальмера), которая даёт возможность определить длины волн всех линий водородной серии (серия Бальмера). Это открытие послужило толчком для обнаружения других серий в спектре атома водорода - серий Лаймана, Пашена, Брэкетта и Пфунда. Первым начал изучение структуры атома. |
В 1885г. швейцарский физик И. Бальмер (1825-1898гг.) установил, что частоты девяти линий в видимой области спектра водорода удовлетворяют соотношению:
![]() (1)
(1)
(1) – формула Бальмера, где:
![]() -
частота световой волны;
-
частота световой волны;
R
- постоянная Ридберга (![]() );
);
n – 3,4,5,…,11.
Все
спектральные линии, удовлетворяющие
соотношению (1) при любых целочисленных
значениях
![]() ,
называются линиями
серии Бальмера.
,
называются линиями
серии Бальмера.
Максимальное
значение частоты в серии Бальмера,
получены при
![]() ,
называется границей
серии Бальмера.
,
называется границей
серии Бальмера.
В начале 20-го века в спектре водорода был обнаружен еще ряд спектральных линий, которые группируются в серии.
В УФ области спектра находится серия Лаймана:
![]() (2)
(2)
m=2,3,…
В ИК области расположены еще 4 серии:
![]() -
серия Пашена (3)
-
серия Пашена (3)
![]() -
серия Брекетта (4)
-
серия Брекетта (4)
![]() -
серия Пфунда (5)
-
серия Пфунда (5)
![]() -
серия Хэмфри (6)
-
серия Хэмфри (6)
Все экспериментально найденные серии спектрах линий атома водорода могут быть описаны одной формулой:
![]() – обобщенная
формула Бальмера (7)
– обобщенная
формула Бальмера (7)
Для каждой серии число m принимает одно из 6-ти значений (1,2,…,6), a n пробегает весь бесконечный ряд целочисленных значений. Эмпирические формулы (1-6) неопровержимо указывали на особую роль целых чисел в спектральных закономерностях, которые, как оказались в дальнейшем, связаны с энергетическими уровнями атома водорода.
Вопрос 4. Модель водородоподобного атома по Бору
Термин
«водородоподобный атом» применим,
помимо атома водорода, к ионам, состоящим
из ядра и только 1-го электрона (![]() и
т.д.)
и
т.д.)
Постулаты Бора
Выход из затруднительного положения, почему же электрон не падает на ядро, был предложен в 1913г. датским физиком Н. Бором. Он ввел идеи квантовой теории в ядерную модель Резерфорда и разработал теорию атома водорода, полностью подтвержденную экспериментально.
В основе боровской теории атома лежат 2 основных положения-постулата:
Электроны могут двигаться в атоме только по определенным орбитам, находясь на которых они, несмотря на наличие у них ускорения, не излучают:
![]() (8)
(8)
![]() -
радиус n-ой
орбиты;
-
радиус n-ой
орбиты;
![]() -
скорость электрона на орбите;
-
скорость электрона на орбите;
![]() -
масса электрона;
-
масса электрона;
![]() -
момент импульса электрона на этой
орбите;
-
момент импульса электрона на этой
орбите;
n
– целое
чисто (![]() )
)
атом излучает или поглощает квант электромагнитной энергии при переходе электрона из одного стационарного состояния в другое:
![]() (9)
(9)
![]() -
энергия кванта равна разности энергий
стационарных состояний электрона до
(
-
энергия кванта равна разности энергий
стационарных состояний электрона до
(![]() )
и после (
)
и после (![]() )
перехода.
)
перехода.
Рассмотрим простейший атом - атом водорода. Он состоит из ядра, в состав которого входит один протон, и одного электрона, вращающегося вокруг ядра по круговой орбите.
На электрон со стороны ядра действует кулоновская сила притяжения, сообщая ему центростремительное ускорение. Поэтому:
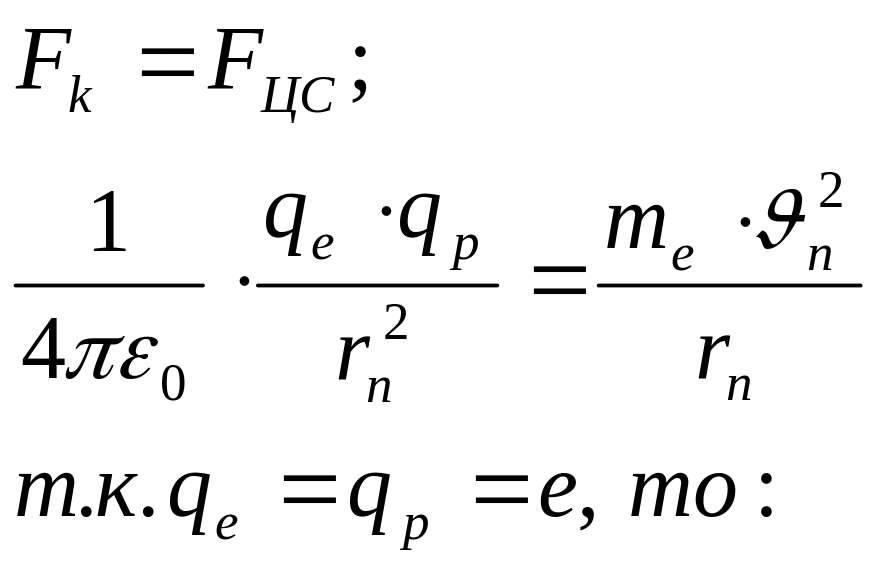
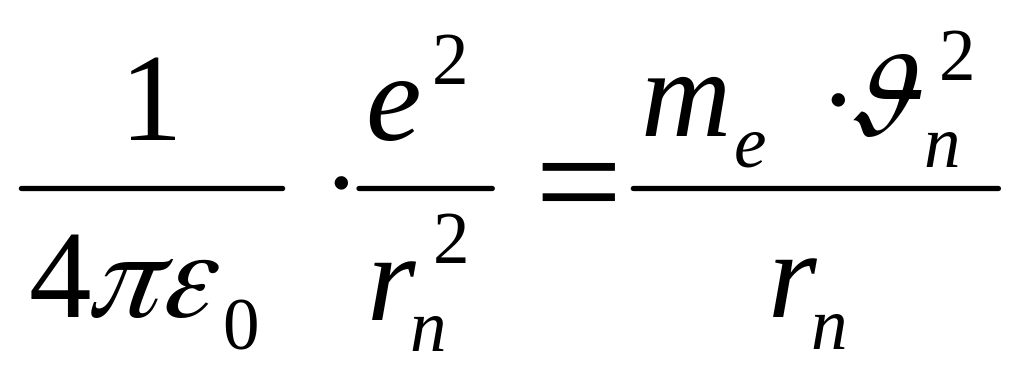 (10)
(10)
где е – заряд электрона и протона,
![]() -
электрическая постоянная (
-
электрическая постоянная (![]() )
)
Поскольку
должен выполняться 1-ый постулат Н. Бора,
то по
![]() определим скорость
,
возведем в квадрат и подставим в (10),
получим:
определим скорость
,
возведем в квадрат и подставим в (10),
получим:
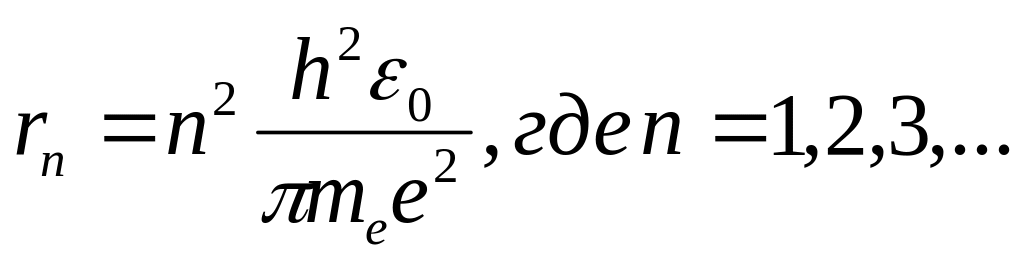 (11)
(11)
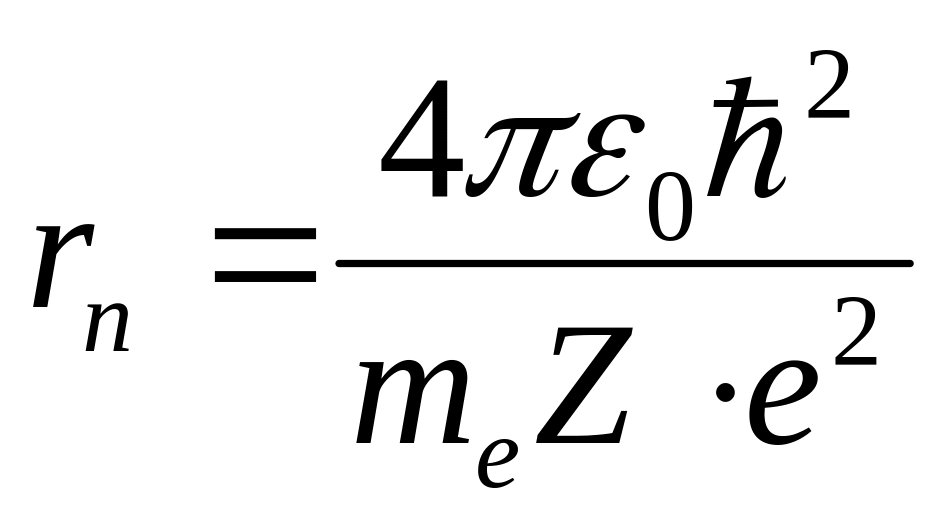
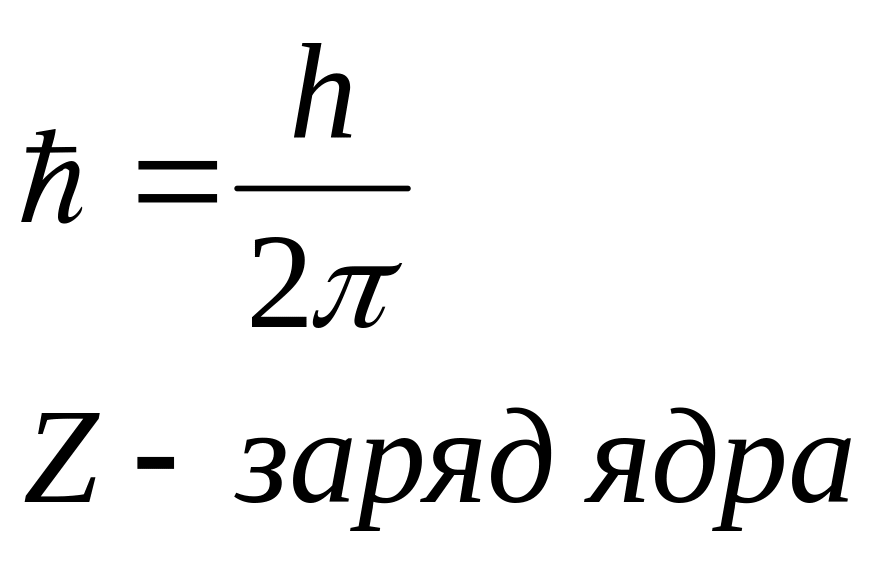
Из
соотношения (11) следует, что радиусы
орбит электрона в атоме водорода
пропорциональны
![]() .
.
Подставив в (11) значения констант и считая n=1, получим значение первого боровского радиуса:
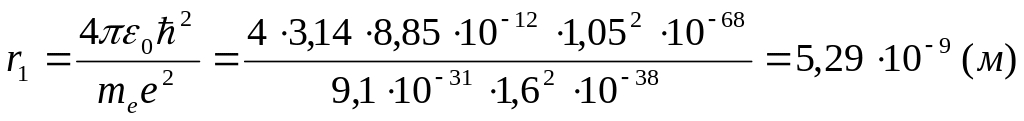
![]()
Скорость электрона:
![]() ,
откуда
,
откуда
![]() (км/с)
- на 1-ом боровском радиусе.
(км/с)
- на 1-ом боровском радиусе.

