
- •Лекция №1 Энергетические ресурсы
- •Виды и классификация тэс
- •Виды и классификация аэс
- •Лекция №2
- •Классификация котлоагрегатов
- •Топливо
- •Состав топлива
- •Характеристики твердого топлива
- •Характеристики жидкого топлива (мазута)
- •Характеристики газового топлива
- •Приведенные характеристики
- •Элементы теории горения
- •Горение жидкого топлива
- •Горение газового топлива
- •Материальный баланс котла Определение теоретически необходимого количества воздуха
- •Контроль избытка и присосов воздуха
- •Определение коэффициента избытка воздуха
- •Энтальпия (теплосодержание) продуктов сгорания
- •Тепловой баланс котла
- •Потеря тепла с уходящими газами
- •Потеря тепла от химической неполноты горения
- •Потеря тепла с механическим недожогом
- •Потеря тепла с физическим теплом шлака
- •Полезно используемое тепло. Кпд котельного агрегата
Характеристики жидкого топлива (мазута)
Свойства мазута разделяют на управляемые и неуправляемые:
управляемые – те, которые могут изменятся в процессе подготовки топлива: вязкость, содержание влаги, плотность, содержание серы.
неуправляемые – те, которые практически не изменяются в процессе подготовки: зольность, температура застывания, температура вспышки, температура воспламенения.
Классификация ведется по условной вязкости и содержанию серы.
В энергетике вязкость мазута принято измерять в градусах условной вязкости.

![]() ,
где
,
где
![]() -время
истечения мазута при температуре t
через калиброванное отверстие вязкозиметра
-время
истечения мазута при температуре t
через калиброванное отверстие вязкозиметра
![]() -
время истечения дистиллированной воды
при t=20оС
через то же отверстие (постоянная
вязкозиметра).
-
время истечения дистиллированной воды
при t=20оС
через то же отверстие (постоянная
вязкозиметра).
Относительная
плотность мазута – это отношение
плотности мазута при данной температуре
к плотности воды при температуре
4°С.  .1<или>1
.1<или>1
Сернистость, зольность, температура вспышки, температура воспламенения, температура застывания.
Характеристики газового топлива
Относительная плотность газового топлива - отношение плотности газа к плотности воздуха при нормальных условиях.
![]()
![]()
н.у. –t=0°С, P=760 мм рт. ст.
Пределы
взрывоопасности. ![]() ,
(нп- нижний предел, вп- верхний предел
взрываемости).
,
(нп- нижний предел, вп- верхний предел
взрываемости).
Токсичность – это способность отравлять живые организмы. Существуют пределы допустимых концентраций.
![]()
![]() .
.
этилмеркаптан
(16 г на 1000 м![]() ).
).
Приведенные характеристики
под приведенными характеристиками понимают отношение характеристики топлива в процентах к 1000 ккал (в системе МКГСС) или к 4190 кДж (в системе СИ) его низшей теплоты сгорания.
![]()
![]() ;
;
![]()
![]() ;
;
![]() (МКГСС);
(МКГСС);
![]() (СИ).
Условное
топливо
(СИ).
Условное
топливо
.
В качестве условного принимают топливо
с теплотой сгорания
![]() или 29,33 МДж/кг.
или 29,33 МДж/кг.
В
соответствии с этим каждое топливо
имеет тепловой эквивалент
 >или<1.
>или<1.
ЛЕКЦИЯ №5
Элементы теории горения
Под горением понимают процесс химического взаимодействия топлива и окислителя, при интенсивном выделении тепла, скачкообразном росте температур, концентрации продуктов горения и снижении концентрации окислителя. При горении происходит преобразование химической энергии топлива в тепловую энергию, идущую на нагрев продуктов сгорания.
Химические реакции, идущие с выделением тепла, называются экзотермическими.

Химические реакции, идущие с поглощением тепла, называются эндотермическими.
![]()
Существуют и другие виды реакций: гомогенные, гетерогенные.
Интенсивность горения характеризуется скоростью химической реакции. Под скоростью гомогенной химической реакции понимают массовое количество вещества, которое реагирует в единицу объема, в единицу времени.
![]()
Считают, что скорость гомогенной реакции подчиняется закону действующих масс, т.е. пропорциональна произведению реагирующих веществ или масс.
![]() ,
где (1)
,
где (1)
m и n – число молей реагирующего вещества, k – постоянная скорости горения.
Например:
![]()
При данной температуре концентрация пропорциональна парциальному давлению соответствующего газа.
![]() (2)
(2)
При сжигании твердого топлива парциальное давление паров продуктов газификации, а следовательно и их концентрации есть величины постоянные при данной температуре.
![]() (3)
(3)
Константа
скорости горения определяется по закону
Аррениуса: ![]()
E –энергия активации;
R –газовая постоянная;
T–температура процесса в градусах °К.
Это выражение показывает, что в реакции участвуют не все молекулы топлива, а только молекулы, обладающие энергией активации, т.е. энергией, достаточной для разрушения внутренних связей.

Для того, чтобы сообщить топливу достаточное количество энергии его необходимо подогреть.
.

Рис. 16 Влияние температуры на величину константу скорости горения
![]()
![]()
![]()
![]()
Таким образом, k показывает долю молекул, участвующих в процессе горения. k - характеристика полного числа столкновений молекул реагирующих веществ.
Горение твердого топлива
Различают два периода:
сушка при температуре около 100°С. Время сушки зависит от влажности, от размеров кусков, от условий теплообмена.
горение состоящее из следующих стадий:
а) выход летучих и образование нелетучего остатка;
б) горение летучих;
в) горение нелетучего коксового остатка.
Примерно 90% времени занимает горение коксового остатка (С).
Учитывают также, что при этом выделяется основное количество тепла. Горение твердого топлива в основном определяется механизмом и кинетикой горения углерода.

Рис. 17 Схема горения коксовой частицы
поверхность коксовой частицы
граница ламинарного слоя
турбулентный поток.
Данное горение протекает на поверхности и относится к гетерогенным реакциям: в этом процессе подводится кислород, который реагирует с частицами твердого топлива.
Скорость химической реакции зависит от скорости подвода кислорода к поверхности реагирования и от кинетики химической реакции.
Количество O , подведенное в единицу времени можно определить.
Поверхность ламинарного слоя
![]() ,
А – коэф. турбулентной диффузии. (4)
,
А – коэф. турбулентной диффузии. (4)
Поверхность частиц:
![]() ,
,
![]() толщина
ламинарного слоя. (5)
толщина
ламинарного слоя. (5)
D – коэффициент молекулярной диффузии.
Совместное решение уравнений (4) и (5):
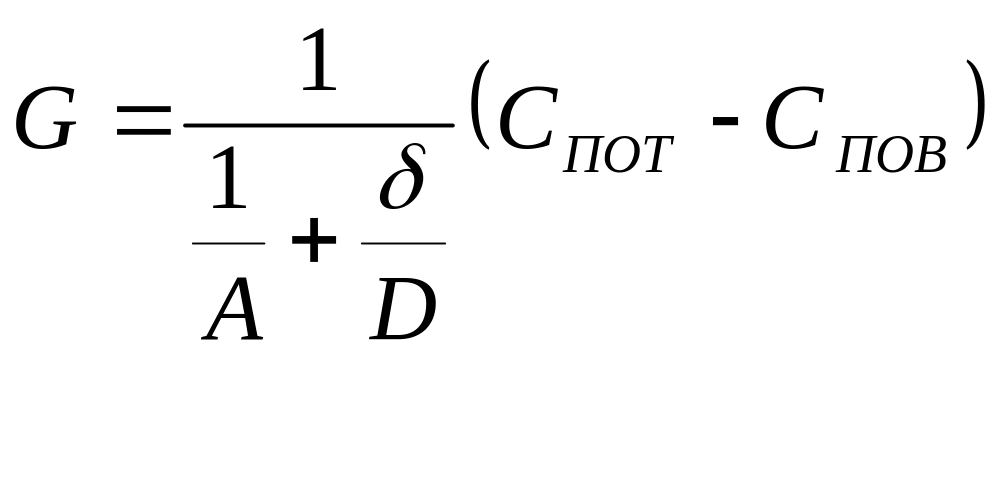 (6)
(6)
![]() (7)
(7)
![]() - константа скорости диффузии.
- константа скорости диффузии.

Таким
образом, количество кислорода, подводимого
к поверхности, является функцией:
![]() .
В свою очередь
является функцией, зависящей от скорости
обтекания, размера частицы и вязкости
потока:
.
В свою очередь
является функцией, зависящей от скорости
обтекания, размера частицы и вязкости
потока:
![]() .
.
При установившемся процессе горения скорость процесса равна скорости подвода кислорода:
![]() (8)
(8)
С другой стороны, ранее получено, что скорость гетерогенного горения равна:
![]() (9)
(9)
Совместное решение уравнений (8) и (9) дает выражение для скорости горения:
 (10)
(10)
![]() (11)
(11)
где
![]() - приведенная константа скорости горения,
представляющая из себя единицу, деленную
на сопротивление процессу горения.
- приведенная константа скорости горения,
представляющая из себя единицу, деленную
на сопротивление процессу горения.
![]() химическое
(кинетическое) сопротивление;
химическое
(кинетическое) сопротивление;
![]() -
диффузионное сопротивление;
-
диффузионное сопротивление;
![]() -
общее сопротивление.
-
общее сопротивление.
В зависимости от соотношения этих сопротивлений, на которые влияют от температура процесса, диаметр частиц, скорость обтекания и т.д., различают кинетическую и диффузионную области горения. Рассмотрим зависимость скорости процесса горения от температуры процесса и диаметра частиц (δ).

![]()
![]()
δ
δ![]()
δ1
![]()
![]()
Рис. 18 Области горения
При низких температурах (t<1000°С), скорость процесса горения ограничивается кинетическим или химическим сопротивлением процесса горения. Определяющим фактором скорости процесса является температура. Область горения называется кинетической – (II).
В области (t>1400°C) скорость реакции горения ограничивается скоростью подвода кислорода. Данная область называется диффузионной (I)
В диапазоне температур 1000-14000С - область III на скорость влияют оба фактора (температура процесса горения и скорость подвода кислорода). Данная область называется промежуточной –(III).
