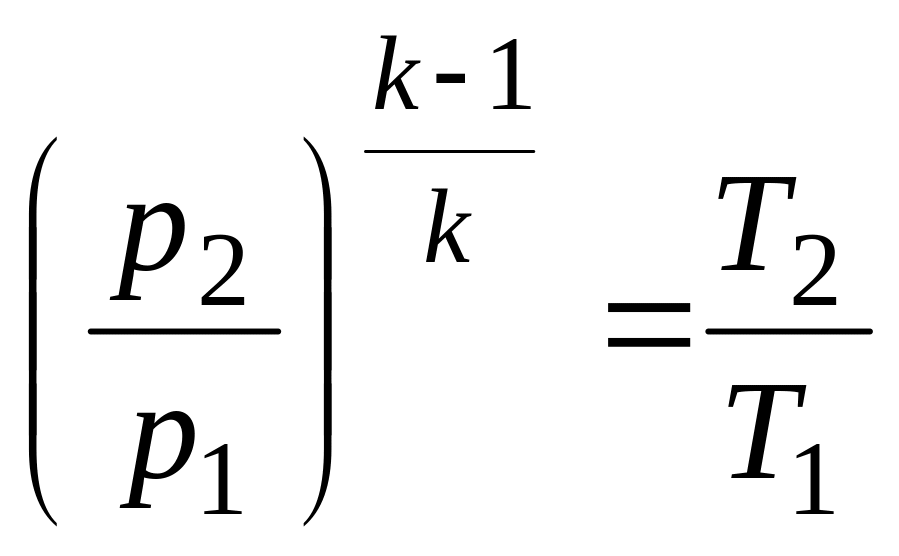- •Общие указания
- •Глава 1
- •1.1. Органические топлива
- •1.1.1. Состав топлив
- •1.1.2. Характеристики топлив
- •1.1.3. Разновидности горения
- •1.1.4. Основные стадии гетерогенного горения
- •1.1.5. Фазы горения
- •1.1.6. Скорость горения
- •1.2. Расчет процессов горения
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Глава 2
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики
- •2.4. Свойства рv – и Тs – диаграмм
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •2.6. Термодинамические циклы
- •Глава 3
- •3. Реальные газы
- •3.1. Отличия реальных газов от идеальных
- •3.2. Устройство pv – диаграммы реального газа
- •3.3. Области pv- диаграммы
- •3.4. Таблицы водяного пара
- •3.5. Определение параметров влажного насыщенного пара
- •3.6. Диаграммы водяного пара
- •3.7. Расчет процессов изменения состояния реального газа (водяного пара)
- •Изохорный процесс ( )
- •Изобарный процесс ( )
- •Изотермический процесс ( )
- •3.9. Паросиловые установки
- •Глава 4 конвективный теплообмен
- •4.1. Математическая формулировка задачи конвективного теплообмена
- •4.2. Краевые условия при решении задач конвективного теплообмена (условия однозначности)
- •4.3. Решение задач конвективного теплообмена на основе теории подобия
- •4.4. Приведение системы дифференциальных уравнений к безразмерному виду
- •4.5. Теоремы подобия
- •4.6. Физический смысл критериев гидромеханического и теплового подобия
- •4.7. Критериальные уравнения конвективного теплообмена
- •4.8. Методика решения задач конвективного теплообмена на основе теории подобия
- •4.9. Выбор определяющих размеров и величин
- •Семестровая работа №1 топливо, газовые смеси и теплоемкость
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •Исходные данные
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №2 термодинамические процессы и циклы с газообразным рабочим телом
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •I. Расчет термодинамических процессов, составляющих цикл
- •II. Расчет прямого цикла 1-2-3-4-5-1
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №3 термодинамические процессы водяного пара
- •Указания к выполнению семестровой работы
- •Исходные данные
- •Методика расчета семестровой работы
- •1. Расчет адиабатного процесса 1-2
- •2. Расчет изобарного процесса 2-3
- •3. Расчет процесса 3-4
- •4. Расчет изобарного процесса 4-5
- •5. Расчет изобарного процесса 5-6
- •6. Расчет изобарного процесса 6-1
- •7. Расчет цикла
- •Контрольные вопросы
- •Основная литература
- •Семестровая работа №4 конвективный теплообмен и интенсификация теплопередачи
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы № 4
- •1. Определяем коэффициент теплоотдачи
- •2. Определяем коэффициент теплоотдачи
- •3.Определяем термические сопротивления
- •4. Определяем коэффициент теплопередачи
- •5. Вычисляем плотность теплового потока
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Приложения
- •Свойства горючих
- •Формулы средних (в интервале 0...Т, к) изохорных массовых
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Физические параметры воды на линии насыщения при давлении 101325 Па (760 мм.Рт.Ст.)
- •Физические параметры сухого воздуха при давлении
- •Оглавление
2.5.6. Адиабатный процесс
Адиабатным называется процесс, в ходе которого система не может обмениваться теплом с окружающей средой.
Необходимым и достаточным условием адиабатного процесса является
![]() . (2.51)
. (2.51)
Для адиабатного процесса в соответствии с (2.51) теплоемкость
![]() .
(2.52)
.
(2.52)
Если рассмотреть (2.19), учитывая (2.52), то в данном случае
![]() ,
(2.53)
,
(2.53)
где k – показатель адиабаты.
Основное уравнение адиабаты получается из (2.22) с учетом (2.53)
![]() . (2.54)
. (2.54)
Иначе
говоря, адиабатный процесс – это частный
случай политропного процесса, когда
![]() .
.
В системе координат адиабатный процесс изображается кривой, близкой к гиперболе. Эта кривая называется адиабатой.
В обратимом адиабатном процессе не происходит изменения энтропии:
![]() или
или
![]() . (2.55)
. (2.55)
В
системе координат
![]() обратимый
адиабатный процесс изображается линией
.
Поэтому данный процесс иначе называют
изоэнтропийным.
обратимый
адиабатный процесс изображается линией
.
Поэтому данный процесс иначе называют
изоэнтропийным.
Формулы соотношения между основными параметрами состояния получаются из соответствующих выражений политропного процесса при замене в них показателя политропы на показатель адиабаты:
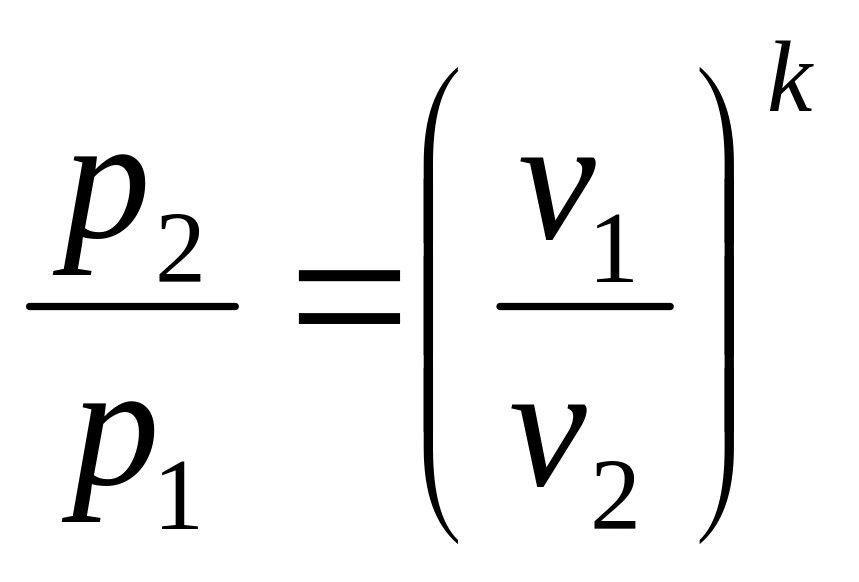 ,
,
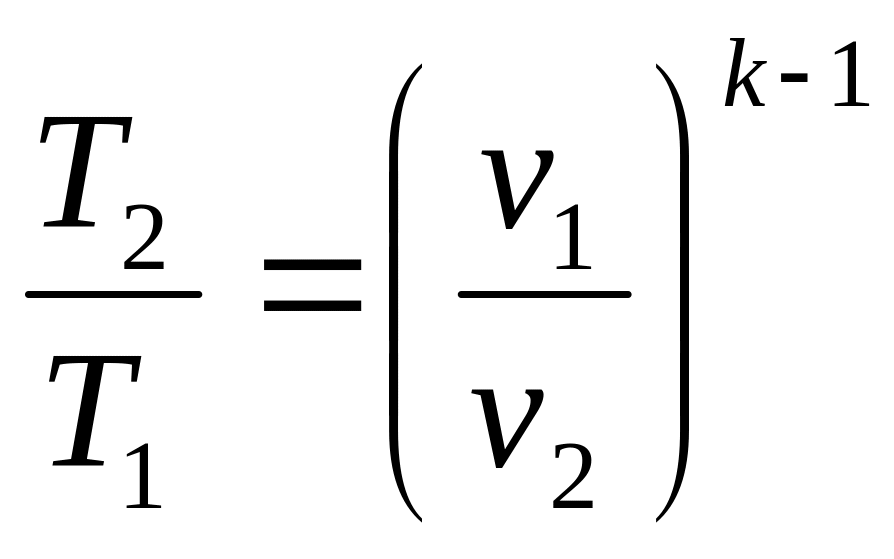 ,
,
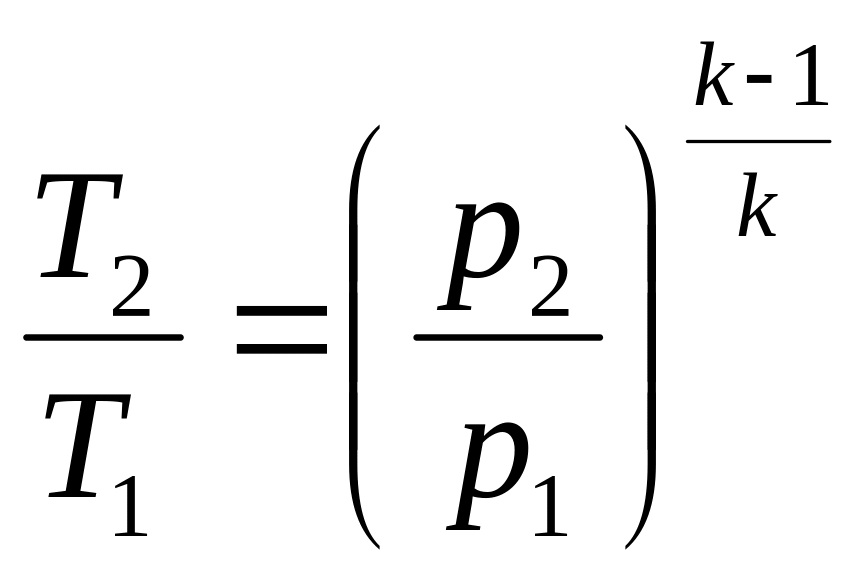 .
(2.56)
.
(2.56)
То же самое получается с формулами для определения работы:
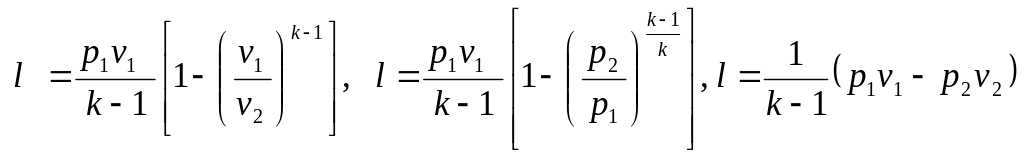
Как и в любом другом процессе изменения состояния идеального газа, изменение внутренней энергии определяется уравнением:
![]() .
.
В связи с тем, что в адиабатном процессе теплообмен с окружающей средой отсутствует, уравнение первого начала термодинамики принимает вид:
![]() или
или
![]() .
.
Таблица 2.1
Сводная таблица частных случаев политропного процесса
Процесс |
n |
Соотношения параметров |
U |
h |
S |
q |
l |
Изохорный v = const |
|
|
|
|
|
|
0 |
Изобарный P = const |
|
|
|
|
|
|
|
Изотермический T = const |
1 |
|
0 |
0 |
|
|
|
Адиабатный dq = 0
|
k |
|
|
|
0 |
0 |
|
2.5.7. Графическое изображение процессов
Графическое изображение термодинамических процессов в координатах Pv- и Ts- приведено на рисунках 2.3 и 2.4 .
З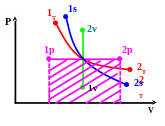 десь
приняты следующие обозначения:
десь
приняты следующие обозначения:
![]() - изохорный процесс;
- изохорный процесс;
![]() -
изобарный процесс;
-
изобарный процесс;
![]() -
изотермический процесс;
-
изотермический процесс;
![]() -
адиабатный процесс.
-
адиабатный процесс.
Рис. 2.3 Рис. 2.4
2.6. Термодинамические циклы
Среди термодинамических процессов особую роль играют замкнутые (круговые) процессы, или циклы, т.е. такие процессы, в ходе которых система возвращается в исходное состояние. В системе координат PV- произвольный круговой процесс изображен на рис. 2.5.
Прямым называется цикл, в котором работа расширения по абсолютной величине больше работы сжатия. Прямой цикл протекает в направлении часовой стрелки.
Обратным называется цикл, в котором работа сжатия по абсолютной величине больше работы расширения.
По прямым циклам работают тепловые двигатели, т.е. машины, преобразующие теплоту в работу. По обратным циклам работают холодильные установки и тепловые насосы.
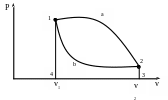
Рис. 2.5. Произвольный круговой процесс. 1a2 – процесс расширения; 2b1 – процесс сжатия.
Как видно из рис 2.5, для прямых циклов характерно то, что процесс расширения (1а2) протекает выше, чем процесс сжатия (2b1). Поэтому работа расширения, численно равная пощади 41а234, оказывается больше работы, затрачиваемой на сжатие (площадь 32b143).
Таким образом, работа, произведенная за прямой цикл, равна разности между работой расширения и работой, затраченной на сжатие, т.е. численно равна площади, ограниченной контуром цикла (площадь 1а2b1):
![]() .
(2.57)
.
(2.57)
Для кругового процесса уравнение первого закона термодинамики имеет вид:
![]() .
(2.58)
.
(2.58)
Здесь
![]() ,
,
![]() и
и
![]() - алгебраические суммы подводимого и
отводимого тепла, изменения внутренней
энергии, работы расширения и сжатия той
совокупности процессов, которая образует
круговой процесс. Поскольку в ходе
кругового процесса система приходит в
исходное состояние, постольку
- алгебраические суммы подводимого и
отводимого тепла, изменения внутренней
энергии, работы расширения и сжатия той
совокупности процессов, которая образует
круговой процесс. Поскольку в ходе
кругового процесса система приходит в
исходное состояние, постольку
![]() .
(2.59)
.
(2.59)
Далее
![]() ,
(2.60)
,
(2.60)
где q1 и q2 – соответственно, абсолютные значения тепла, подводимого и отводимого в ходе процессов, образующих цикл.
Совместное рассмотрение (2.57) – (2.60) приводит к уравнению
![]() .
(2.61)
.
(2.61)
Уравнение
(2.61) является выражением первого закона
термодинамики для круговых процессов.
Из него следует, что получаемая за цикл
работа равна разности между подводимым
и отводимым за цикл теплом. Как следует
из сказанного выше, в прямых циклах q1
всегда больше (![]() ),
т.к.
),
т.к.
![]() .
.
Уравнение
(2.61) отрицает возможность создания
вечного двигателя первого рода.
Действительно, если нет затраты энергии
(![]() ),
то и работа за цикл будет равна нулю.
),
то и работа за цикл будет равна нулю.
Степень
термодинамического совершенства цикла
оценивается термическим КПД (![]() ),
который характеризует, какая часть
подводимого за цикл тепла (q1)
превращается в работу:
),
который характеризует, какая часть
подводимого за цикл тепла (q1)
превращается в работу:
![]() .
.
При прочих равных условиях наибольшим термическим КПД обладают циклы, составленные из обратимых процессов (обратимые циклы), т.к. в них нет рассеивания энергии из-за протекания диссипативных процессов.
По
этой же причине для обратимых процессов
![]() ,
а для необратимых
,
а для необратимых![]() .
.
Из всех обратимых циклов наибольшим термическим КПД обладает известный из курса физики цикл Карно, состоящий из двух изотерм и двух адиабат. В TS-диаграмме этот цикл показан на рис. 2.6.
Использование свойств TS-диаграммы позволяет легко получить для этого цикла выражение термического КПД.
Действительно:
![]() или
или
![]() .
.
Иначе, для обратимого цикла Карно
![]() (2.69)
(2.69)
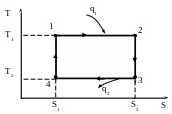
Рис. 2.6. Теоретический обратимый цикл Карно. 1 – 2 – изотермическое расширение; 2 – 3 – адиабатное расширение; 3 – 4 – изотермическое сжатие; 4 –1 – адиабатное сжатие.
Таким образом, термический КПД цикла Карно не зависит от свойств рабочего тела, а целиком определяется температурами, при которых подводится (Т1) и отводится (Т2) тепло.
Поскольку
не может быть
![]() или Т2
= 0, постольку, как видно из (2.69), даже для
обратимого цикла Карно
или Т2
= 0, постольку, как видно из (2.69), даже для
обратимого цикла Карно
![]() .
В реальных условиях цикл Карно не может
быть реализован. Величина термического
КПД цикла Карно определяет предельно
возможное значение этого КПД, которое
в принципе может быть достигнуто в
данном интервале температур Т1
– Т2.
.
В реальных условиях цикл Карно не может
быть реализован. Величина термического
КПД цикла Карно определяет предельно
возможное значение этого КПД, которое
в принципе может быть достигнуто в
данном интервале температур Т1
– Т2.