
- •Технологія водопідготовки лабораторний практикум
- •«Хімічна технологія»
- •Передмова
- •Назва лабораторних робіт, їх зміст, об'єм і модулі, до яких вони належать та назви модулів
- •Система критеріїв оцінювання знань з лабораторних робіт
- •Модуль № 1
- •Модуль № 2
- •Яка призначається для питних і виробничих потреб»
- •Модуль № 3
- •Принцип компановки технологічних схем»
- •Модуль № 4
- •Модуль № 5
- •Модуль № 6
- •Модуль № 7
- •Правила оформлення лабораторних робіт
- •Техніка безпеки в хімічній лабораторії
- •Визначення фізичних показників якості води поверхневого джерела
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •Для отримання шкали кольоровості
- •Очікуваного вмісту зависі
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Визначення ступеня мінералізації дніпрової води
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •Прожареного залишку
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Пом’якшення і допом’якшення природної води реагентними методами
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •І допом’якшення води фосфатним методом
- •5 Контрольні запитання
- •6 Література
- •Визначення хлорпоглинаємості і показника, який відображає як хлорується вода
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •Як хлорується вода
- •5 Контрольні запитання
- •6 Література
- •Побудова градуювального графіка
- •1 Метод вимірювання
- •2 Порядок виконання роботи
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Визначення оптимальної дози коагулянту
- •1 Фізико – хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •5 Контрольні запитання
- •6 Література
- •Вивчення впливу вапнування на процес коагуляційної очистки води
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •5 Контрольні запитання
- •6 Література
- •Визначення динамічної обмінної ємності
- •1 Фізико-хімічні основи процесу
- •3 Приготування розчинів
- •4 Порядок виконання роботи
- •До проскакування у фільтрат іонів кальцію
- •5 Методи контролю
- •6 Вимоги до звіту
- •7 Контрольні запитання
- •8 Література
- •Вивчення процесів опріснення і знесолення води
- •1 Фізико-хімічні основи процесу
- •3 Приготування розчинів
- •4 Опис лабораторної установки
- •5 Порядок виконання роботи
- •6 Методи контролю
- •7 Вимоги до звіту
- •Шляхом перегонки
- •8 Контрольні запитання
- •9 Література
- •Список рекомендованої літератури
- •Додаток а Приклад оформлення титульного аркушу лабораторної роботи
- •Додаток б Приклад оформлення титульного аркушу звіту з лабораторних робіт
5 Література
Кульский Л.А., Строкач П.П. Технология очистки природных вод. – К.: Вища школа. Головне вид-во, 1986. – 352 с.
Кульский Л.А., Накорчевская В.Ф. Химия воды. Физико-химические процессы обработки природных вод. – К.: Вища школа. Головне вид-во, 1983. – 240 с.
Набиванець Б.Й., Сухан В.В., Калабіна Л.В. Аналітична хімія природного середовища. – К.: Либідь, 1996. – 304 с.
ГОСТ 3351-74. Вода питьевая. Методы определения вкуса, запаха, цветности, мутности.
Запольський А.К. Водопостачання, водовідведення та якість води. – К.: Вища школа, 2005. – 671 с.
Лабораторна робота № 2
Визначення ступеня мінералізації дніпрової води
Мета роботи. Визначити ступінь мінералізації дніпрової води.
1 Фізико-хімічні основи процесу
Природна вода представляє собою складну дисперсну систему, яка містить велику кількість різноманітних мінеральних і органічних домішок.
В природних водах зустрічається багато хімічних елементів. До найбільш важливих відносяться натрій(Nа), кальцій(Са), магній(Мg) і хлор(Сl), які присутні у вигляді простих іонів (Nа+, Са2+, Мg2+ і Сl-), а також карбон, сульфур, нітроген, оксисен, гідроген, силіцій (С, S, N, O, H, Sі), які знаходяться у вигляді складних іонів (НСО3-, СО32-, SО42-, NО3-), недисоційованих молекул і колоїдів (Н2SіО3) і розчинених газів (СО2, Н2S, О2 тощо).
Як правило, перераховані елементи зустрічаються в кількостях, вимірюваних міліграмами в 1 дм3, однак вміст деяких з них може досягати грамів і навіть десятків грамів в 1 дм3 води.
Для вод звичайного типу найбільш уживаними є класифікація неорганічних домішок води С.О. Щукарєва та О.О. Альокіна, а для мінеральних вод – класифікація В.О. Александрова.
Класифікація С.О. Щукарєва заснована на принципі переваги одного або декількох з трьох головних катіонів – йону натрію, йону кальцію, йону магнію (Nа+, Са2+, Мg2+) і трьох головних аніонів–хлор – іон, сульфат(2–) – аніон, гідроген карбонат – аніон (Сl-, SО42-, НСО3-). Вода відноситься до того або іншого класу в залежності від вмісту іонів, що вказані, у кількості, що перевищує 25%-екв. Комбінуючи типи вод за вмістом катіонів, отримують 49 класів вод. Наприклад, вода може називатися гідроген карбонатною натрієво-кальцієвою або сульфат гідроген карбонатною кальцієвою. Кожний клас вод поділено на групи за загальною мінералізацією:
група А – до 1,5 г/дм3,
В – від 1,5 до 10 г/дм3,
С – більше 10 г/дм3.
Класифікація О.О. Альокіна поєднує принцип ділення за іонами, що переважають, і за співвідношенням між ними. Всі води поділяють на три великих класи за аніоном, що переважає, : гідрогенкарбонатні (карбонатні), сульфатні і хлоридні. Всередині кожного класу виділяються три групи за переважанням одного із катіонів: Са2+, Мg2+, Nа+ (або К+). В свою чергу, в групах розрізняють три типи вод, що визначаються таким співвідношенням:
І – НСО3- > Са2+ + Мg2+;
ІІ – НСО3- < Са2+ + Мg2+ < НСО3- + SО42-;
ІІІ – НСО3- + SО42- < Са2+ + Мg2+.
Використання цієї класифікації дозволяє вияснити походження природних вод і охарактеризувати їх властивості.
За вмістом іонів (солей) у воді визначають загальну ступінь її мінералізації М за формулою:
![]() (1)
(1)
де ∑ Каm – сума катіонів, мг/дм3;
∑ Ан – сума аніонів, мг/дм3.
Для перевірки правильності обчислювання ступеня мінералізації природної води результати перераховують у міліграм-еквіваленти на дм3. При цьому суми концентрацій у воді катіонів і аніонів повинні бути однаковими згідно закону електронейтральності:
![]()
![]()
В такому балансовому рівнянні необхідно враховувати вміст всіх іонів, концентрація яких перевищує 0,01 мг-екв/дм3. Добре виконаним вважається аналіз, коли розходження між сумами у правій і лівій частинах рівняння складає ± 1 %; цілком допустимим – при розходженні ± 2 – 3 %; (при малому ступеню мінералізації). Якщо похибка перевищує 5 %, а при значному ступеню мінералізації – 3 %, то аналіз вважається неточним.
Похибку аналізу χ розраховують за формулою:
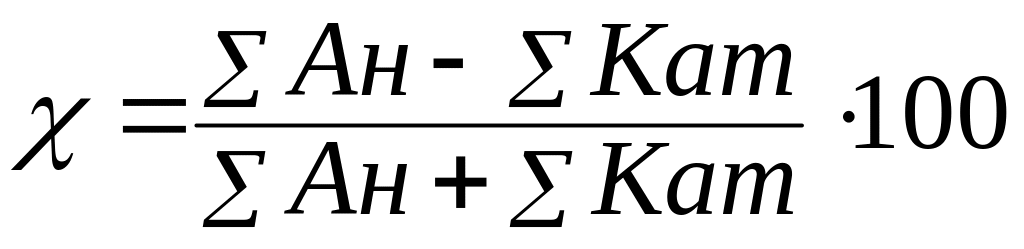 . (2)
. (2)
За вмістом солей природні води розподіляються на сім груп (див. табл. 1).
Таблиця 1 – Вміст солей у природній воді
Група |
Вид води |
Вміст солей у воді, г/дм3 |
1 |
Ультрапрісна |
До 0,1 |
2 |
Прісна |
0,1 – 1,0 |
3 |
Слабкосолона |
1 – 3 |
4 |
Солона |
3 – 10 |
5 |
Сильносолона |
10 – 50 |
6 |
Розсоли |
50 – 300 |
7 |
Ультрарозсоли |
більше 300 |
Про вміст солей в природних водах можна міркувати за кількістю сухого і прожареного залишків. Сухий залишок, що утворюється при випарюванні визначеного об’єму води, попередньо профільтрованої через паперовий фільтр «синя стрічка», складається із мінеральних солей і нелетких органічних з’єднань.
