
- •Рецензент:
- •Введение
- •Лабораторная работа №1 Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание.
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опытов
- •2.2.1Оксиды их получение и свойства
- •2.2.2 Гидроксиды, их получение и свойства
- •2.2.2.2 Опыт 2 Получение нерастворимого основания
- •Необходимый уровень знаний студентов
- •Уметь писать уравнения реакций, отражающие химические свойства оксидов и гидроксидов.
- •Задания для самоконтроля
- •Лабораторная работа №3 Основные классы неорганических соединений: кислоты и соли
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Кислоты, их получение и свойства
- •3.2.2 Соли, их получение и свойства
- •3.2.2.5 Опыт 5 Получение солей взаимодействием двух солей
- •3.3 Необходимый уровень знаний студентов
- •3.3.4 Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •3.4 Задания для самоконтроля
- •Лабораторная работа №4 Определение молярной массы эквивалента цинка
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Обработка результатов опыта
- •4.3 Примеры решения задач
- •4.4 Необходимый уровень знаний студентов
- •4.5 Задания для самоконтроля
- •Лабораторная работа №5 Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень знаний студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опытов
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень знаний студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Приготовление растворов заданной концентрации
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Примеры решения задач
- •7.4 Необходимый уровень знаний студентов
- •7.5 Задания для самоконтроля
- •Лабораторная работа №8 Малорастворимые электролиты. Произведение растворимости
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опытов
- •8.3 Необходимый уровень знаний студентов
- •8.4 Задания для самоконтроля
- •Литература
- •Содержание
- •Пашаян арарат александрович
- •Методические указания по выполнению лабораторных работ
Лабораторная работа №6 Химическое равновесие
Цель работы: изучение влияния различных факторов на химическое равновесие.
Оборудование и реактивы: разбавленные растворы хлорида железа (III) и роданида аммония в бюретках, концентрированный раствор FeCI3, твердый хлорид аммония и роданид аммония, нитрат свинца (II), штатив и 4 пробирки, U-образная трубка, пробки с газоотводными трубками, спиртовка, два химических стакана, лед, электрическая плитка.
6.1 Теоретические пояснения
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции прям. равна скорости обратной реакции обрат.. Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия. Для обратимой реакции
Н2(г) +I2(г) = 2HI(г)
константа равновесия имеет вид:
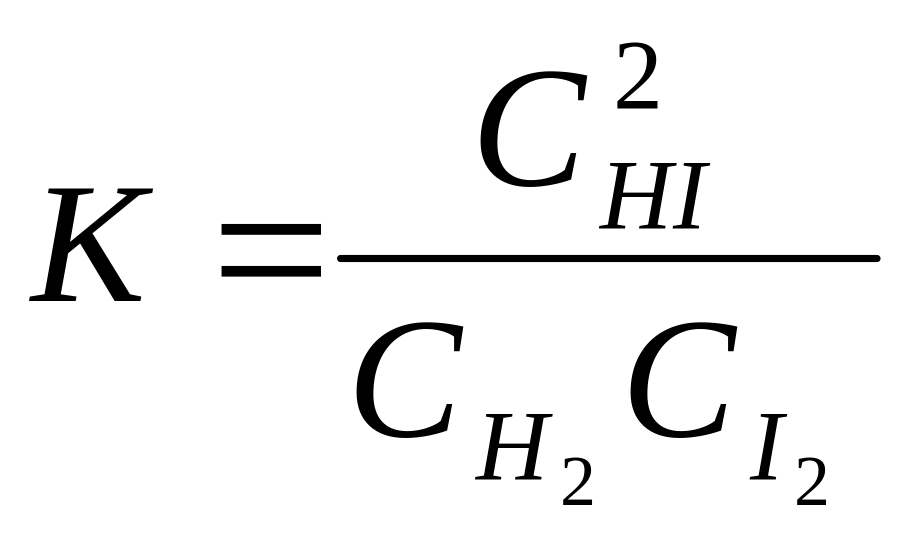 (6.1)
(6.1)
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии , оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
6.2 Методика проведения опытов
6.2.1 Опыт 1 Влияние концентрации веществ на химическое равновесие.
В данном опыте изучают обратимую реакцию взаимодействия хлорида железа (III) с роданидом аммония. Роданид железа Fe(NCS)3 придает раствору красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(NCS)3 т.е. о смещении равновесия в ту или иную сторону.
В четыре пробирки внесите по 5-10 капель разбавленных растворов хлорида железа (III) FeCI3 и роданида аммония NH4CNS. Легким встряхиванием пробирок размешайте растворы. Поставьте все пробирки в штатив.
В одну из пробирок добавьте несколько капель концентрированного раствора хлорида железа (III), в другую - несколько кристаллов роданида аммония, в третью - хлорида аммония, четвертую пробирку оставьте для сравнения.
Растворы размешайте энергичным встряхиванием или стеклянной палочкой.
При оформлении отчета отметьте изменение интенсивности окраски в каждом случае; запишите уравнение реакции между FeCI3 и NH4CNS и выражение константы равновесия данной реакции.
В каком направлении смещается равновесие и как изменяется концентрация каждого компонента в случае добавления: а) хлорида железа (III); б) роданида аммония; в) хлорида аммония?
6.2.2 Опыт 2 Влияние температуры на химическое равновесие.
В данном опыте изучают реакцию димеризации диоксида азота:
2NO2 = N2O4
NO2 - очень опасное вещество. (Опыт проводить в вытяжном шкафу!). По изменению окраски газовой смеси можно судить о концентрации ее компонентов, т.е. о смещении равновесия в сторону прямой или обратной реакции.
U-образную трубку, с двумя хорошо подобранными резиновыми пробками наполните диоксидом азота, который получите разложением нитрата свинца. Реакция протекает по уравнению
2Pb(N03)2 = 2РЬО + 4NO2 + О2
Оба конца U-образной трубки плотно закройте резиновыми пробками и, перевернув ее концами вниз, поместите одно колено трубки в стакан с горячей водой, другой в стакан с ледяной водой (холодную и горячую воду приготовьте заранее).
Наблюдайте изменение окраски в том и другом колене U-образной трубки. Выньте трубку из стаканов, и то колено, которое было в холодной воде, опустите в горячую воду, а колено из горячей воды - в холодную. Наблюдайте вновь изменение окраски в каждом колене.
В каком направлении происходит смещение равновесия данной реакции при нагревании и охлаждении? Объясните смещение химического равновесия. Результаты наблюдений и выводов запишите в табл. 6.1
Таблица 6.1- Характеристики химического равновесия
Номер пробирки
|
Добавленное вещество
|
Степень изменения окраски раствора
|
Направление смещения равновесия
|
1
|
|
|
|
2 |
|
|
|
3 |
|
|
|
