
- •Механические колебания
- •Простейшие колебательные системы
- •Энергия при гармонических колебаниях
- •Вынужденные колебания. Резонанс
- •Автоколебания
- •Молекулярная физика. Идеальный газ Молекулярно – кинетическая теория
- •Идеальный газ
- •Термодинамика
- •Первое начало термодинамики
- •Второе начало термодинамики
- •Свойства жидкостей и твердых тел Реальный газ
- •Сжижение газов. Влажность
- •Поверхностное натяжение
- •Агрегатные состояния. Фазовые переходы
- •Упругие свойства твердых тел
- •Тепловое расширение
- •Электричество и магнетизм электростатика Электрический заряд
- •Закон Кулона
- •Электрическое поле. Напряженность
- •Теорема Гаусса
- •Вычисление электрических полей с помощью теоремы Гаусса
- •Потенциал
- •Проводники в электрическом поле
- •Диэлектрики в электрическом поле
- •Электроемкость
- •Конденсаторы
- •Постоянный ток Сила тока
- •Электродвижущая сила
- •Закон Ома
- •Измерение силы тока и напряжения
- •Законы Кирхгофа
- •Работа и мощность тока
- •Электрический ток в различных средах Электрический ток в металлах
- •Электрический ток в полупроводниках
- •Электрический ток в электролитах
- •Электрический ток в газах
- •Электрический ток в вакууме
Автоколебания
На тот факт, что период гармонических колебаний не зависит от амплитуды, впервые обратил внимание Галилео Галилей и он впервые догадался, что на этом свойстве гармонических колебаний можно было бы создать часы. Галилей разработал принципиальную схему часового механизма, однако ему не удалось обойти трудность, связанную с затуханием всех реальных свободных колебаний. Дело в том, что реальными незатухающими колебаниями могут быть только вынужденные колебания, в то время как свойством независимости периода колебаний от амплитуды обладают только свободные гармонические колебания. В часовом механизме необходимо было совместить оба эти условия. Впервые практически решить эту задачу удалось голландскому физику Христиану Гюйгенсу. Он создал колебательную систему, которая совершает колебания практически свободно, но в определенные моменты времени к системе подключается внешняя сила, которая в течение очень короткого промежутка времени компенсирует потери энергии. Гюйгенс сконструировал так называемый анкерный механизм, благодаря которому колебательная система в каждом периоде колебаний в определенный момент сама подключает внешнюю силу, которая легким толчком компенсирует потери энергии за период. Таким образом, колебания получаются вынужденными, но частота внешней силы задается самой колебательной системой и соответствует частоте собственных колебаний. Такие колебания называются автоколебаниями.
Молекулярная физика. Идеальный газ Молекулярно – кинетическая теория
Все тела состоят из молекул. Зачатки подобных взглядов возникли в эпоху античной древности. В V веке до н. э. Левкипп, а более подробно его ученик Демокрит разработали атомистическую теорию, согласно которой все тела состоят из мельчайших неизменяемых и неделимых частиц – атомов. Различное расположение и движение этих частиц определяет свойства тел. Однако эта теория являлась чисто умозрительной, ничем не обоснованной философской гипотезой и фактически на два с лишним тысячелетия была забыта.
Лишь в XVII Френсис Бекон, Гассенди и Бойль попытались связать тепловые свойства тел с движением составляющих их мельчайших частиц. Гассенди предложил назвать эти частицы молекулами. В XVIII веке Бернулли количественно объяснил результаты опытов Бойля на основе молекулярных представлений. И в середине XIX века усилиями Клаузиуса, Максвелла и Больцмана было, наконец, закончено развитие молекулярно - кинетической теории и заложены основы статистической физики.
Итак, все тела состоят из молекул. Однако, что считать молекулой? Довольно быстро, в основном, в результате химических экспериментов выяснилось, что частицы, которые следовало бы считать молекулами, часто сами состоят из более мелких частиц, которые назвали атомами. Кроме того у многих веществ, особенно кристаллических, мельчайшими структурными частицами являются как раз атомы (ионы), а не молекулы. Поэтому под молекулой мы будем понимать мельчайшую частицу вещества, полностью определяющую все химические свойства этого вещества. Сами молекулы чаще всего состоят из атомов химических элементов. Под атомом мы будем понимать мельчайшую частицу вещества, полностью определяющую все химические свойства данного химического элемента. Количество различных атомов в природе ограничено. В настоящее время их известно чуть белее сотни. А количество различных молекул, которые могут получиться в результате их комбинаций, ничем не ограничено.
Масса молекул.
Физики давно пытались измерять массы молекул. Сначала для этого использовались химические методы, а в настоящее время массу отдельной молекулы или атома можно сравнительно легко и очень точно измерить методами масс – спектрометрии. Оказалось, что массы всех атомов и молекул с очень большой точностью кратны одной и той же величине. Эта минимальная масса называется атомной единицей массы и равна:
1 а. е. м. ≈ 1,66·10-27 кг
Массу атома любого химического элемента или молекулы можно записать так: Mx = n·1 а. е. м. Здесь n является целым числом и называется относительной атомной или молекулярной массой. Атомная единица массы практически равна массе атома водорода, однако, за единицу массы атомов и молекул принимается 1/12 часть массы атома изотопа углерода 12С. Относительная атомная или молекулярная масса показывает во сколько раз масса данного атома или молекулы больше, чем 1 а. е. м.
В 1818 году Авогадро сформулировал утверждение о том, что в равных объемах любых газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Это утверждение, называемое законом Авогадро, позволяет ввести физическую величину – количество вещества. Единица количества вещества называется моль [моль]. Одним молем вещества называется количество этого вещества, содержащее число молекул, равное числу молекул в 12 граммах изотопа углерода 12С. Таким образом, в одном моле любого вещества содержится одно и то же число молекул (для атомарных веществ молекула и атом – это одно и то же). Эта величина называется числом Авогадро и равна:
NA ≈ 6,02·1023 моль-1
Количеством вещества называется отношение количества молекул данной массы вещества к числу Авогадро:
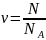
Масса одного моля вещества называется молярной массой. Если масса m вещества содержит количество вещества ν, то молярная масса равна:
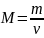
Молярной массой вещества можно также назвать массу данного вещества, содержащего число молекул, равное числу Авогадро. Единицей измерения молярной массы является [кг/моль].
Если известна молярная масса вещества, то масса одной молекулы этого вещества равна:
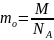
Размеры молекул.
Размеры
молекул очень малы, однако их грубую
оценку можно получить достаточно легко.
Если предположить, что в жидкостях и
твердых телах молекулы расположены
почти вплотную друг к другу, то разделив
объем жидкости на количество молекул
в ней, мы получим объем, приходящийся
на одну молекулу. Так, например, масса
одного моля воды равна 18 г, а объем
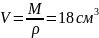 .
Так как в одном моле воды находится NA
молекул, то на одну молекулу воды
приходится объем:
.
Так как в одном моле воды находится NA
молекул, то на одну молекулу воды
приходится объем:
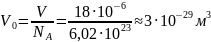
Значит, грубо размер молекулы воды равен:
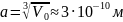
Если предположить, что масло растекается по поверхности воды пленкой толщиной в одну молекулу, то размер молекулы масла можно оценить, капнув каплю масла известного объема на поверхность воды и измерив площадь получившейся масляной пленки.
Размеры атомов и молекул в настоящее время измеряются с большой точностью. Самый маленький размер имеет атом водорода – он равен примерно 10-10 м.
Основные положения молекулярно – кинетической теории.
В основе молекулярной физики лежат четыре утверждения, которые называются основными положениями молекулярно – кинетической теории.
1. Все вещества состоят из молекул. Масса любого тела равна сумме масс составляющих его молекул.
2. Молекулы находятся в непрерывном хаотическом движении. Хаотичность движения молекул - важнейшая особенность молекулярного теплового движения.
3. Движение каждой отдельной молекулы подчиняется законам классической механики.
4. Молекулы взаимодействуют друг с другом. В зависимости от расстояния между молекулами они либо отталкиваются, либо притягиваются.
Перечисленные четыре положения еще можно назвать аксиомами. Они являются результатом огромного числа экспериментальных наблюдений и теоретических предсказаний. Рассмотрим некоторые явления, которые можно считать экспериментальными обоснованиями основных положений молекулярно – кинетической теории.
Ряд явлений природы свидетельствует о беспорядочном движении молекул. Прежде всего, это диффузия. Очень легко происходит диффузия в газах. Например, хорошо известно, что воздух на самом деле является смесью различных газов, основными из которых являются азот и кислород. Плотность кислорода немного больше плотности азота, а это значит, что весь кислород воздуха должен опуститься вниз, а азот подняться вверх. Однако на самом деле разделения воздуха на отдельные газы не происходит. В результате беспорядочного движения молекулы кислорода и азота перемешиваются.
Диффузия в жидкостях тоже происходит достаточно быстро. Если в стакан с водой капнуть каплю чернил, то достаточно быстро капля чернил расплывается и получается однородный окрашенный раствор.
Диффузия в твердых телах происходит значительно медленнее, но и здесь опытом можно показать диффузию. Если хорошо отполировать и очистить поверхности двух металлов, например, золота и серебра и плотно прижать их друг к другу, то через достаточно длительное время граница контакта металлов окажется слегка размытой. Это означает, что молекулы золота поникли в серебро и наоборот.
О непрерывном движении молекул свидетельствуют также такие явления как растворение и испарение. Причем с увеличением температуры скорости диффузии, растворения и испарения увеличиваются. Это может означать, что скорость движения молекул зависит от температуры и увеличивается с ее увеличением.
Наиболее наглядным проявлением беспорядочного движения молекул явилось броуновское движение. В 1827 г. английский ботаник Броун, рассматривая в микроскоп частицы пыльцы, растворенные в жидкости, заметил, что они находятся в постоянном беспорядочном движении. Сначала Броун предположил, что частицы пыльцы «живые» и движутся сами. Однако, прокипятив раствор, он обнаружил, что движение частиц сохраняется. Это явление может быть объяснено только с точки зрения молекулярного строения вещества и непрерывного беспорядочного движения молекул.
Молекулы жидкости, в которой находится частица пыльцы, непрерывно двигаясь, сталкиваются с поверхностью частицы. В результате столкновения молекула отражается от поверхности частицы и передает ей некоторый импульс. Причем, в силу беспорядочности или хаотичности движения молекул в каждый момент времени с разных сторон с частицей сталкивается различное число молекул, а значит суммарный импульс, передаваемый молекулами частице не равен нулю, и частица получает толчок. В следующий момент частица получает толчок в другом случайном направлении и так далее.
В 1905 г. А. Эйнштейн, исходя из молекулярных представлений, построил теорию броуновского движения. Он показал, как должна двигаться броуновская частица. Французский физик Перрен провел серию экспериментов, в которых показал, что броуновская частица движется именно так как предсказывает теория Эйнштейна.
Скорости движения молекул.
До середины XIX века считалось, что молекулы вещества движутся хаотически, но с одинаковыми по модулю скоростями. Считалось, что с увеличением температуры тела скорость движения всех его молекул увеличивается одинаково. В 1859 г. английский физик Джеймс Максвелл вывел закон распределения молекул по скоростям. Оказалось, что молекулы движутся с различными скоростями. В любой момент времени имеются молекулы, имеющие маленькие скорости и очень большие скорости движения. Однако таких молекул очень мало. Большинство молекул имеют скорости не очень сильно отличающиеся от так называемой наиболее вероятной скорости. Эта скорость зависит от температуры: при увеличении температуры она возрастает, а при понижении – уменьшается. Довольно неожиданной оказалась величина скорости молекулярного движения. Из распределения Максвелла следовало, что при обычных температурах скорости молекул составляют сотни метров в секунду (для самых легких молекул водорода около 1500 м/с). По оценкам из скорости диффузии скорости молекулярного движения ожидались значительно меньшие.
Н епосредственное
измерение скорости молекул впервые
было выполнено Штерном в 1920 г. Принципиальная
схема установки опыта Штерна выглядит
так. Имеются два коаксиальных цилиндра,
вдоль общей оси которых натянута
металлическая проволока. В стенке
внутреннего цилиндра имеется узкая
щель. Если раскалить проволоку, пропустив
по ней ток, то из нее начинают вылетать
атомы металла. Пролетев сквозь щель они
осаждаются на стенке внешнего цилиндра,
образуя на ней узкую полоску металла в
точке А1.
Если раскрутить систему вокруг оси,
проходящей вдоль проволоки, то атомы
металла будут попадать на поверхность
внешнего цилиндра в другой точке А2.
Зная радиусы цилиндров и угловую скорость
их вращения, можно рассчитать скорость
движения атомов металла. Пусть радиусы
цилиндров равны R1
и R2,
а угловая скорость их вращения ω. Время,
за которое атом металла летит от
внутреннего цилиндра до внешнего, равно
епосредственное
измерение скорости молекул впервые
было выполнено Штерном в 1920 г. Принципиальная
схема установки опыта Штерна выглядит
так. Имеются два коаксиальных цилиндра,
вдоль общей оси которых натянута
металлическая проволока. В стенке
внутреннего цилиндра имеется узкая
щель. Если раскалить проволоку, пропустив
по ней ток, то из нее начинают вылетать
атомы металла. Пролетев сквозь щель они
осаждаются на стенке внешнего цилиндра,
образуя на ней узкую полоску металла в
точке А1.
Если раскрутить систему вокруг оси,
проходящей вдоль проволоки, то атомы
металла будут попадать на поверхность
внешнего цилиндра в другой точке А2.
Зная радиусы цилиндров и угловую скорость
их вращения, можно рассчитать скорость
движения атомов металла. Пусть радиусы
цилиндров равны R1
и R2,
а угловая скорость их вращения ω. Время,
за которое атом металла летит от
внутреннего цилиндра до внешнего, равно
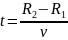
За
это время система повернется на угол
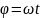 .
Соответственно длина дуги А1А2
равна
.
Соответственно длина дуги А1А2
равна
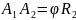 .
Отсюда получаем формулу для скорости
атомов металла:
.
Отсюда получаем формулу для скорости
атомов металла:
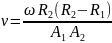
Полученные в результате опытов Штерна значения скорости атомов металла оказались в полном соответствии с распределением Максвелла.
Взаимодействие молекул
Молекулы взаимодействуют друг с другом. На очень малых расстояниях молекулы отталкиваются, а на больших – притягиваются. Силы молекулярного взаимодействия имеют электромагнитную природу. Они зависят от химического состава вещества и от строения молекул. Общей теории этих сил до сих пор нет, однако известны некоторые закономерности.
С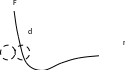 читается,
что силы отталкивания и притяжения
действуют одновременно и на любых
расстояниях. Просто эти силы по разному
зависят от расстояния между молекулами.
И те и другие силы при уменьшении
расстояния между молекулами возрастают,
а при увеличении – убывают. Но силы
отталкивания зависят от расстояния
гораздо сильнее, чем силы притяжения.
Поэтому, если молекулы приближать друг
к другу, то возрастают и сила отталкивания
и силы притяжения, однако силы отталкивания
возрастают быстрее и на очень маленьких
расстояниях суммарная сила есть сила
отталкивания. Если удалять молекулы
друг от друга, то уменьшаются и силы
отталкивания и силы притяжения. Однако
силы притяжения уменьшаются медленнее
и начиная с некоторого расстояния они
начинают преобладать, то есть общая
сила становится силой притяжения. При
дальнейшем увеличении расстояния сила
притяжения все более преобладает, то
есть суммарная сила притяжения возрастает,
а начиная с некоторого расстояния
начинает уменьшаться, довольно быстро
стремясь к нулю. Примерный график
зависимости силы межмолекулярного
взаимодействия от расстояния между
молекулами приведен на рисунке. На этом
графике положительные значения силы –
это сила отталкивания, а отрицательные
– сила притяжения. При некотором значении
расстояния суммарная сила равна нулю,
то есть сила отталкивания равна силе
притяжения. При уменьшении расстояния
возникает суммарная сила отталкивания
и она очень быстро возрастает. Если
представлять молекулы в виде шариков,
то можно сказать, что когда суммарная
сила равна нулю, молекулы находятся
вплотную друг к другу. Поэтому при
дальнейшем их сближении начинается
деформация молекул и они очень сильно
начинают отталкиваться. Поэтому
расстояние, на котором сила взаимодействия
молекул равна нулю, называется эффективным
диаметром молекулы.
При увеличении расстояния между
молекулами возникает суммарная сила
притяжения, которая сначала возрастает,
а затем начинает убывать и на расстоянии
3 – 4 диаметров молекул убывает практически
до нуля.
читается,
что силы отталкивания и притяжения
действуют одновременно и на любых
расстояниях. Просто эти силы по разному
зависят от расстояния между молекулами.
И те и другие силы при уменьшении
расстояния между молекулами возрастают,
а при увеличении – убывают. Но силы
отталкивания зависят от расстояния
гораздо сильнее, чем силы притяжения.
Поэтому, если молекулы приближать друг
к другу, то возрастают и сила отталкивания
и силы притяжения, однако силы отталкивания
возрастают быстрее и на очень маленьких
расстояниях суммарная сила есть сила
отталкивания. Если удалять молекулы
друг от друга, то уменьшаются и силы
отталкивания и силы притяжения. Однако
силы притяжения уменьшаются медленнее
и начиная с некоторого расстояния они
начинают преобладать, то есть общая
сила становится силой притяжения. При
дальнейшем увеличении расстояния сила
притяжения все более преобладает, то
есть суммарная сила притяжения возрастает,
а начиная с некоторого расстояния
начинает уменьшаться, довольно быстро
стремясь к нулю. Примерный график
зависимости силы межмолекулярного
взаимодействия от расстояния между
молекулами приведен на рисунке. На этом
графике положительные значения силы –
это сила отталкивания, а отрицательные
– сила притяжения. При некотором значении
расстояния суммарная сила равна нулю,
то есть сила отталкивания равна силе
притяжения. При уменьшении расстояния
возникает суммарная сила отталкивания
и она очень быстро возрастает. Если
представлять молекулы в виде шариков,
то можно сказать, что когда суммарная
сила равна нулю, молекулы находятся
вплотную друг к другу. Поэтому при
дальнейшем их сближении начинается
деформация молекул и они очень сильно
начинают отталкиваться. Поэтому
расстояние, на котором сила взаимодействия
молекул равна нулю, называется эффективным
диаметром молекулы.
При увеличении расстояния между
молекулами возникает суммарная сила
притяжения, которая сначала возрастает,
а затем начинает убывать и на расстоянии
3 – 4 диаметров молекул убывает практически
до нуля.
В твердом и жидком состояниях молекулы вещества находятся на расстоянии равном эффективному диаметру молекул, поэтому силы взаимодействия между ними в среднем равны нулю. В газе расстояние между молекулами значительно больше их размеров. Поэтому взаимодействие молекул газа тоже пренебрежимо мало.
Идеальный газ.
Наиболее простым агрегатным состоянием вещества с точки зрения молекулярного описания является газообразное. Поэтому в дальнейшем мы будем, в основном, рассматривать газ. Газ представляет собой совокупность хаотически движущихся молекул. При обычных условиях, то есть при давлениях и температурах близких к нормальным (нормальными условиями называется состояние газа при давлении 105 Па и температуре 0 °С) расстояние между молекулами газа примерно в 10 раз превышает размеры молекул. Поэтому молекулы друг с другом практически не взаимодействуют. Они взаимодействуют друг с другом только при непосредственных столкновениях, которые ввиду малости молекул происходят довольно редко. Для упрощения теоретических рассмотрений мы будем рассматривать так называемый идеальный газ. Перечислим признаки идеального газа.
1. Размеры молекул пренебрежимо малы по сравнению с расстояниями между молекулами. Поэтому молекулы идеального газа часто можно считать материальными точками.
2. Молекулы взаимодействуют друг с другом только при непосредственных столкновениях. Между столкновениями молекулы движутся равномерно и прямолинейно.
3. Столкновения молекул между собой и со стенками сосуда абсолютно упругие.
Идеальный газ – очень разреженный газ. Так как в разреженном газе столкновения между молекулами – явление относительно редкое, то очень часто ими пренебрегают вообще и считают, что молекулы идеального газа сталкиваются только со стенками сосуда.
Несмотря на такое обилие упрощений и пренебрежений все окружающие нас газы с большой точностью можно считать идеальными.
Следует еще сказать, что мы будем рассматривать только равновесные состояния систем. Состояние системы считается равновесным, если при отсутствии внешних воздействий все параметры состояния системы сохраняют свои значения в течение сколь угодно долгого времени. Равновесное состояние не меняется со временем. Систему можно вывести из равновесия внешним воздействием, но после прекращения воздействия любая система спустя некоторое время приходит в состояние равновесия и самопроизвольно из него не выходит. Мы будем рассматривать различные процессы перевода газа из одного состояния в другое. Это осуществляется путем внешних воздействий и, конечно, равновесное состояние газа при этом нарушается. Но если процесс перехода осуществлять очень медленно, то можно считать, что в любой промежуточной точке процесса система практически успевает принять равновесное состояние. Такие очень медленные процессы называются квазистатическими. Мы будем рассматривать только квазистатические процессы.
Давление газа. Основное уравнение молекулярно – кинетической теории.
Р ассмотрим
идеальный газ, находящийся в кубическом
сосуде со стороной а.
Пусть все молекулы газа одинаковые и
их общее количество равно N.
Введем систему координат XYZ,
направив оси вдоль ребер. Предположим
для простоты, что все молекулы газа
движутся только в трех направлениях,
вдоль осей X,
Y
и Z.
Так как скорости молекул направлены
хаотично, то вдоль каждой оси движется
одинаковое количество молекул, то есть
ассмотрим
идеальный газ, находящийся в кубическом
сосуде со стороной а.
Пусть все молекулы газа одинаковые и
их общее количество равно N.
Введем систему координат XYZ,
направив оси вдоль ребер. Предположим
для простоты, что все молекулы газа
движутся только в трех направлениях,
вдоль осей X,
Y
и Z.
Так как скорости молекул направлены
хаотично, то вдоль каждой оси движется
одинаковое количество молекул, то есть
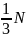 .
Причем ровно половина из этих молекул
движется в положительном направлении
оси и половина в отрицательном. Рассмотрим
молекулу массой m,
летящую вдоль оси Х на правую стенку со
скоростью v.
В результате абсолютно упругого
столкновения со стенкой скорость
молекулы изменится на противоположную,
то есть импульс молекулы изменится на
величину
.
Причем ровно половина из этих молекул
движется в положительном направлении
оси и половина в отрицательном. Рассмотрим
молекулу массой m,
летящую вдоль оси Х на правую стенку со
скоростью v.
В результате абсолютно упругого
столкновения со стенкой скорость
молекулы изменится на противоположную,
то есть импульс молекулы изменится на
величину
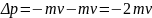
Такой
же по модулю и противоположный по знаку
импульс молекула передаст стенке. В
следующий раз молекула столкнется с
этой же стенкой через время
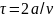 .
Значит за время Δt
молекула столкнется с правой стенкой
.
Значит за время Δt
молекула столкнется с правой стенкой
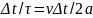 раз и передаст стенке импульс:
раз и передаст стенке импульс:
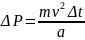
Средняя сила, с которой рассматриваемая молекула действует на правую стенку равна:
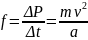
Суммарная сила, действующая на правую стенку сосуда со стороны всех находящихся в нем молекул равна
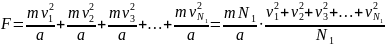
Здесь
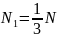 .
Величина
.
Величина
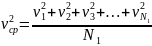
представляет собой средний квадрат скоростей молекул, а скорость
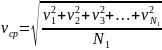
называется среднеквадратичной скоростью молекул.
Итак получаем, что на правую стенку со стороны молекул действует сила
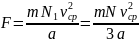
Такая же сила действует со стороны молекул и на все другие стенки сосуда. Давление молекул на стенку сосуда равно:
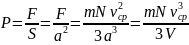
Здесь
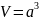 - объем сосуда. Величина
- объем сосуда. Величина
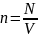
называется концентрацией молекул и показывает сколько молекул находится в единице объема. В результате получаем давление, которое оказывает идеальный газ на стенки сосуда:
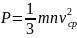
Это
уравнение называется основным
уравнением молекулярно – кинетической
теории. Его
можно записать в другом виде. Если
обозначить
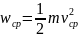 - средняя кинетическая энергия движения
молекул, то
- средняя кинетическая энергия движения
молекул, то
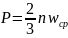
Величина
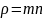 – плотность газа. Тогда получаем:
– плотность газа. Тогда получаем:
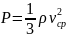
Таким образом получается, что давление газа – есть результат столкновений его молекул со стенками сосуда. Основное уравнение молекулярно – кинетической теории связывает микропараметры газа (масса молекул, их концентрация и средняя скорость движении) с его макропараметром – давлением, легко измеряемой величиной. При выводе этого уравнения нами были сделаны серьезные упрощения. Однако они не сказались на результате. Строгий вывод этого уравнения нам пока не доступен, но он приводит к такому же результату.
Температура.
Опыт показывает, что если два различно нагретых тела привести в соприкосновение, то более нагретое тело будет остывать, а менее нагретое – нагреваться. С течением времени система придет в состояние равновесия, котором оба тела будут одинаково нагреты. Все тела имеют некоторое свойство, характеризующее степень их нагретости. При объединении двух тел это свойство изменяется так, что через некоторое время становится одинаковым. Это свойство называется температурой.
А что происходит при установлении контакта двух тел с молекулярной точки зрения? При контакте двух тел молекулы одного тела будут сталкиваться с молекулами другого тела. Предположим теперь, что средняя кинетическая энергия молекул первого тела больше чем у второго. При столкновениях молекулы тел будут обмениваться энергиями. Причем статистический анализ молекулярных столкновений показывает, что молекулы, имеющие большие кинетические энергии в среднем будут отдавать энергию молекулам с меньшей энергией. Таким образом, возникнет поток энергии от первого тела ко второму. Этот процесс перехода энергии будет продолжаться до тех пор, пока средние кинетические энергии движения молекул обоих не сравняются. Следует заметить, что в результате межмолекулярных столкновений происходит выравнивание именно средней кинетической энергии, а не средней скорости движения молекул. Значит, равенство температур двух тел при их контакте означает равенство средних кинетических энергий движения их молекул. При этом молекулы тел по-прежнему будут обмениваться энергиями, но суммарный поток энергии от первого тела ко второму будет равен суммарному потоку энергии от второго тела к первому. Такое состояние называется термодинамическим равновесием.
Таким образом, температуру тела можно было бы определить просто как среднее значение кинетической энергии движения его молекул. Однако это вызвало бы некоторые неудобства. Во-первых, к тому времени как была выяснена связь между температурой и средней кинетической энергией движения молекул тела, уже существовали несколько устоявшихся понятий температуры. Уже существовали несколько температурных шкал. Наиболее устоявшиеся и распространенные из них: это температурные шкалы Цельсия, Реомюра и Форенгейта. Кроме того, средняя кинетическая энергия движения молекул тела – величина очень маленькая и пользоваться такой маленькой величиной в повседневной жизни очень неудобно. Поэтому в начале XIX века Больцманом была предложена новая температурная шкала, основанная на физическом смысле понятия температуры.
Температура – есть мера средней кинетической энергии движения молекул тела. Причем, в новом определении температуры была сделана попытка привязать ее к наиболее распространенной шкале температур Цельсия. Величина Т, определяемая через среднюю кинетическую энергию движения молекул тела, как
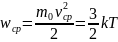
называется абсолютной температурой. Между абсолютной температурой и температурой по шкале Цельсия имеется простая связь:
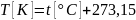
Единица измерения абсолютной температуры в системе СИ является Кельвин [К]. Коэффициент пропорциональности k называется постоянной Больцмана и равен
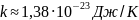
Размер
одного градуса Цельсия равен размеру
одного Кельвина. Таким образом разница
температур по шкале Цельсия и Кельвина
одинаковая (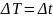 ).
Температура Т = 0 К = −273 °С называется
абсолютным
нулем температуры.
С классической точки зрения при этой
температуре прекращается молекулярное
движение, то есть все молекулы
останавливаются.
).
Температура Т = 0 К = −273 °С называется
абсолютным
нулем температуры.
С классической точки зрения при этой
температуре прекращается молекулярное
движение, то есть все молекулы
останавливаются.
