
Методы исследования и контроля качества металлов и сплавов
Для исследования строения (структуры) металлов и сплавов и их свойств используют макро- и микроанализ, рентгеновский, термический, дилатометрический и другие методы анализа.
Неразрушающий контроль качества металлов и сплавов выполняют с использованием магнитной, ультразвуковой и рентгеновской дефектоскопии, а также других методов контроля.
Макроскопический, анализ (макроанализ) представляет собой метод изучения строения металлов и сплавов (их структуры ) невооружённым глазом или при небольших увеличениях (до 10 раз, например, с помощью лупы). Макроанализ позволяет выявить неметаллические включения, пористость, усадочную раковину, трещины, а также определить расположение волокон при прокатке, ковке, штамповке и т. д. 102
Для осуществления макроанализа готовят специальный образец—шлиф. После шлифования поверхность шлифа обезжиривают, промывают спиртом и подвергают травлению погружением шлифа в реактив. Реактивы обычно состоят из кислот и щелочей или их растворов, а также растворов солей, которые по-разному растворяют или окрашивают отдельные составляющие сплава. Для различных металлов и сплавов выбирают разные реактивы. После травления, промывки в холодной и горячей воде и сушки шлифа рассматривают строение металла или сплава—структурные составляющие, наличие неметаллических включений или раковин и т. д. На основании этих наблюдений структуры делают качественную оценку исследуемого металла.
Микроскопический анализ (микроанализ) — метод изучения строения металлов и сплавов с помощью специального металлографического микроскопа при больших увеличениях (до 3000 раз). С помощью микроанализа определяют величину и форму кристаллов и структурные составляющие сплавов, выявляют особенности строения структуры, наличия в ней микродефектов ( трещин, раковин, и т.д.) или неметаллических включений и т.п.
Шлиф для микроанализа приготовляют так же, как и для макроанализа, но после шлифования дополнительно производят полирование для получения зеркальной поверхности.
Наличие и характер неметаллических включений определяют по нетравленым шлифам, а для выявления количества и формы тех или иных структурных составляющих шлифы подвергают травлению в специальных реактивах. Наиболее распространённый реактив для выявления структуры углеродистой стали 4 %-ный_ раствор азотной кислоты в этиловом спирте. После травления, промывки и сушки шлифа его рассматривают под микроскопом, работающим с помощью отраженного света. Благодаря различной ориентировке кристаллов металла степень их травимости реактивами также оказывается разной. Когда шлиф рассматривают под микроскопом, свет неодинаково отражается от различных зерен. Благодаря примесям границы зерен металла травятся сильнее, чем основной металл, и
более рельефно выявляются.
При травлении шлифа, приготовленного из сплава, его микроструктура выявляется вследствие различной травимости структурных составляющих (фаз). В этом случае на микрошлифе образуется рельеф. Все это позволяет определять микроструктуру - форму и размеры зерен исследуемого металла или сплава.
Наряду с обычными оптическими микроскопами широко применяют электронные микроскопы, в которых вместо световых используются электронные лучи. Эти лучи испускает раскаленная вольфрамовая спираль. Электронный микроскоп позволяет получить увеличение в 100000 раз и выше.
Рентгеновский анализ позволяет исследовать типы кристаллических решеток металлов и сплавов и определить их параметр. Для анализа используют ренгеновские лучи, получаемые в специальных рентгеновских трубках.
Определение структуры металлов и типа кристаллической решетки при помощи рентгеновских лучей основано на дифракции (отражении) рентгеновских лучей рядами атомов кристаллической решетки. Зная длину волны рентгеновских лучей можно определить расстояние между рядами атомов и расположение их в пространстве. Установление атомной структуры металлов и сплавов весьма существенно для понимания физической природы явлений, происходящих при изменении состояния металла в процессе его обработки.
Термический анализ применяют для определения критических точек при нагревании и охлаждении металлов и сплавов с последующим построением диаграмм состояния (см. рис. 4.8,4.9, 411).
Кривые нагревания и охлаждения металлов и сплавов позволяют определить температуры превращений и выбрать рациональный температурный интервал обработки металлов или сплавов.
Дилатометрический анализ основан на изменении объема металла или сплава, происходящем при нагревании или охлаждении. Его применяют для определения критических точек и коэффициентов теплового расширения металлических образцов.
При нагревании объем увеличивается плавно или скачкообразно; плавно он увеличивается при отсутствии фазовых превращений в металле и скачкообразно при их наличии. По результатам анализа, выполняемого на специальных приборах (дилатометрах), строят кривые (в координатах температура—удлинение образца), по которым определяют температуру фазовых превращений.
Магнитную дефектоскопию применяют для контроля качества готовых деталей, сварных швов и т. д. с целью выявления внутренних дефектов (закалочных и усталостных трещин, неметаллических включений, усадочных раковин и т. д.). На практике используют такие методы магнитной дефектоскопии, как магнитных суспензий, индукционный и др.
Испытание методом магнитных суспензий или сухого порошка состоит из намагничивания контролируемой детали (ток намагничивания до 2000.. .3000 А), покрытия ее ферромагнитным порошком (например, порошком железа), осмотра испытуемой поверхности и размагничивания детали. У намагниченных деталей, имеющих внутренние дефекты (трещины, неметаллические включения или другие дефекты), образуется неоднородное магнитное поле вследствие того, что магнитные силовые линии огибают место дефекта. При покрытии изделия магнитным порошком его частицы, располагаясь над дефектом, образуют резко очерченный рисунок, отражающий форму и величину дефекта металла. Для обнаружения дефектов методом магнитных суспензий или сухого порошка в ферромагнитных сплавах применяют специальные аппараты—магнитные дефектоскопы.
Этот метод контроля осуществляется быстро, надежно и применим для массового контроля качества продукции.
Ультразвуковую дефектоскопию применяют для контроля качества отливок, поковок и готовых деталей не только из ферромагнитных, но из любых металлов и сплавов и для выявления макро- и микродефектов, залегающих на значительной глубине (до 10 м). При проверке качества деталей с помощью ультразвуковых дефектоскопов различной конструкции применяют ультразвуковые упругие колебания с частотой 104... 107 Гц.
Ультразвуковой дефектоскоп состоит из генератора электрических колебаний, пьезоэлектрических щупов излучателей, усилителя электрических колебаний и индикатора (показывающего стрелочного прибора или осциллографа). В промышленности применяют ультразвуковые дефектоскопы с непрерывным излучением и импульсные.
В ультразвуковых дефектоскопах с непрерывным излучением (типа УЗД-6) ультразвуковые волны, направленно распространяясь в металле от щупа-излучателя, не проходят через встречающиеся в нем дефекты (внутренние трещины, усадочные раковины или газовые пузыри, расслоения, неметаллические включения и т. д.), создавая за дефектом область «звуковой тени», что отмечается на индикаторе усилителя. Ко входу усилителя подключен щуп-приемник, расположенный соосно на противоположной стороне изделия. Это позволяет выявить место и глубину залегания дефекта.
В импульсных ультразвуковых дефектоскопах (типа УЗД-7Н) ультразвуковая волна, распространяющаяся в исследуемом материале, при встрече с препятствием в виде дефекта отражается от него. Отраженные волны принимаются, усиливаются и передаются на показывающий индикатор. Импульсные дефектоскопы могут работать с одним или с двумя щупами, прикладываемыми к изделию только с одной стороны. Это является одним из важных преимуществ импульсных дефектоскопов, позволяющих производить контроль изделия при доступе к нему только с одной стороны в отличие от теневых дефектоскопов.
При помощи ультразвуковой дефектоскопии, кроме определения макро- и микродефектов, в металлических телах измеряют глубину закаленного или цементованного слоя, определяют внутренние напряжения, модуль упругости, плотность металла и т. д.
Рентгеноскопия (просвечивание) металлов и сплавов основана на способности рентгеновских лучей проходить через оптически непрозрачные среды и предназначены для выявления внутренних дефектов (пористости, трещин, газовых пузырей, шлаковых включений и др.). В местах дефектов рентгеновские лучи поглощаются меньше, чем в сплошном металле, и поэтому на фотопленке такие лучи образуют темные пятна, соответствующие форме дефекта. Рентгеноскопию, как и ультразвуковую дефектоскопию, в настоящее время широко применяют в промышленности для поточного контроля массовой продукции.
Контрольные вопросы
1. Какие существуют виды и порядок испытаний для определения прочностных характеристик и твердости металлов, их показатели и размерности?
2. Виды и порядок испытаний для определения характеристик пластичности, ударной вязкости и предела усталости металла.
3. Какие вы знаете виды разрушения металлов и их сущность?
4. Методы исследования и контроля качества металлов, их сущность и области применения.
5.2. Основные типы диаграмм двухкомпонентных систем
Диаграммы состояния представляют собой графическое изображение всех превращений, протекающих в сплавах в зависимости от температуры и концентрации компонентов. Превращения в сплавах при нагреве или охлаждении зависят от того, какие фазы при этом образуются. Под_фазой понимают однородную часть системы, отделенную от других частей поверхностью раздела. Так, однородная жидкость представляет собой однофазную систему, а жидкий сплав и находящиеся в нем кристаллы
или механическая смесь кристаллов двух видов—двухфазную систему.
Система может состоять из одного или нескольких компонентов, например, система медь—никель состоит из двух компонентов: меди и никеля.
Различают четыре главных типа диаграмм состояния двойных сплавов: 1) механическая смесь; 2) твердый раствор с неограниченной растворимостью; 3) твердый раствор с ограниченной растворимостью и 4) химическое соединение. Диаграммы состояния двойных сплавов строят в двух измерениях:
по оси ординат откладывают температуру, а по оси абсцисс— концентрацию компонентов. Общее содержание двухкомпонентного сплава в любой точке абсциссы равно 100 %, а крайние ординаты соответствуют чистым компонентам. Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре.
Правило фаз. Различные изменения системы, происходящие в зависимости от внешних условий (например, температуры), подчиняются правилу фаз. Последнее устанавливает зависимость между числом компонентов, числом и числом степеней свободы системы.
Под числом степеней свободы (вариантность) системы понимают число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменить без изменения числа фаз данной системы.
Правило фаз для металлических систем при постоянном давлении выражается уравнением
С = К + 1 - Ф ,
где С—число степеней свободы системы; К – число компонентов, образующих систему; Ф—число фаз, находящихся в равновесии; 1 — число внешних переменных факторов (температура).
В процессе затвердевания чистого металла (К==1, Ф=2)— система нонвариантная (безвариантная), так как, согласно приведенной формуле,
С =0. В системе нельзя произвольно изменять внешний фактор (температуру), не изменяя числа фаз и равновесия системы.
Чистый расплавленный металл (К= 1, Ф=1) представляет моновариантную (одновариантную) систему с одной степенью свободы
(С =1). Сохраняя металл в жидком виде, можно в определенных пределах (выше точки плавления) изменять температуру, не изменяя числа фаз и равновесия системы. Если двухкомпонентная система находится в расплавленном состоянии (К =2, Ф==1), то имеем две степени свободы (С=2), т. е. систему бивариантную (двухвариантную). В этом случае существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы. Для этой же системы при наличии двух фаз (жидкой и твердой) имеем К. =2, Ф=2 и С=1, т. е. с изменением температуры концентрация должна быть строго определенной.
Диаграмма состояния I типа.
По этой диаграмме кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, а в твердом образуют механическую смесь. .
Диаграмму состояния строят на основании кривых охлаждения ряда сплавов данной системы. По остановкам и перегибам на кривых охлаждения, вызванных тепловым эффектом превращения (скрытой теплотой кристаллизации и перекристаллизации), определяют критические точки, которые используют для построения диаграмм состояния.
Рассмотрим систему свинец—сурьма и для шести ее сплавов построим кривые охлаждения (рис. 5.3, а). Чистые металлы имеют одну критическую точку—температуру затвердевания (кристаллизации), а сплавы—две, причем вторая критическая точка для всех сплавов соответствует одной температуре 246 °С. При этой температуре состав жидкой фазы всех сплавов одинаковый (13% Sb, 87% Рb). Это происходит
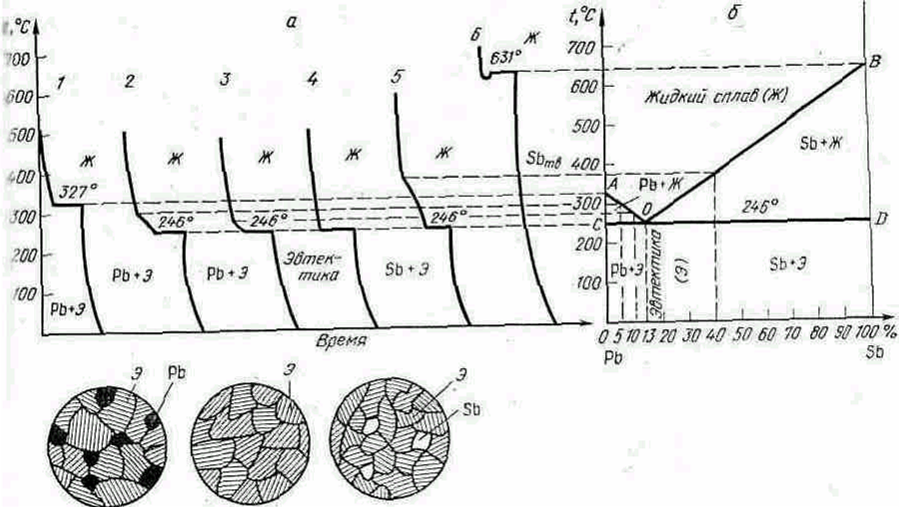
Рис. 5.3. Диарамма состояния 1 типа ( сплавы системы свинец – сурьма) :
а - кривые охлаждения; б – диаграмма состояния схемы структур, соответственно доэвтектического, эвтектического и заэвтектического сплавов : 1 – 100% Pb, 2 – 95%Pb, 5%Sb; 3 – 90%Pb, 10%Sb; 4 – 87%Pb, 13%Sb; 5 – 60% Pb, 40% Sb; 6 – 100% Pb.
потому, что процесс кристаллизации сплавов, содержащих 5 и 10% Sb, начинается с выделения кристаллов чистого свинца, а кристаллизация сплава, содержащего 40 % Sb, начинается с выделения кристаллов чистой сурьмы. Вследствие этого в первом случае остающийся жидкий сплав обедняется свинцом и обогащается сурьмой, а во втором, наоборот, обедняется сурьмой и обогащается свинцом. При достижении температуры 246 °С из жидкой фазы одновременно выделяются кристаллы свинца и сурьмы, образуя механическую смесь.
Механическую смесь кристаллов двух видов, одновременно кристаллизующихся из жидкого сплава при постоянной температуре, называют эвтектикой.
Для построения диаграммы состояния (рис. 5.3, б) на оси. абсцисс откладываем составы шести сплавов и восстанавливаем из соответствующих точек вертикальные линии. Затем переносим из кривых охлаждения сплавов критические точки, соединив которые получаем диаграмму состояния. При этом для упрощения не принято во внимание, что свинец и сурьма незначительно растворяются в твердом состоянии.
Верхняя кривая АОВ соответствует температуре начала кристаллизации сплавов, а нижняя прямая СОД—температуре конца кристаллизации. Первую называют линией ликвидус, и вторую — солидус. Сплавы, содержащие меньше 13% Sb, называют доэвтектическими (рис. 4.11), а сплавы, содержащие больше 13%, — заэвтектическими (рис..5.3). В точке О кристаллизуется сплав эвтектической концентрации. Структура сплава состоит только из эвтектики (рис. 5.3). .
По диаграмме состояния I типа кристаллизуются сплавы Zn—Sn, Рb—Sn, Рb—Аg, Ni—Сr , Cr – Mn, Cu—Вi, А1—Si.
Диаграмма состояния II типа. .
По этой диаграмме кристаллизуются сплавы, оба компонента которых неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
Рассмотрим систему медь—никель для пяти её сплавов следующей концентрация: 1) 100% Сu; 2) 80% Сu+20% Ni;
3) 60% Сu+40% Ni; 4) 20% Сu+80 % Ni; 5) 100 % Ni. Кривые охлаждения этих сплавов (рис. 5.4, а) имеют разную температуру конца кристаллизации. Это свидетельствует о том, что состав фазы непрерывно изменяется. Диаграмму состояния (рис. 5.4, б) строим так же, как и диаграмму I типа. Верхняя кривая Ааа1а2В соответствует температуре начала кристаллизации сплавов (линия ликвидус), а нижняя кривая Аb1b2B — температуре конца кристаллизации (линия солидус). Выше линии ликвидуса сплав находится в однофазном жидком состоянии, а.ниже линии солидуса—в однофазном твердом состоянии в виде твердого α-раствора (рис. 5.4, в). Между линиями
ликвидус и солидус сплав находится в двухфазном состоянии (жидкая фаза и кристаллы твердого α-раствора).
Рассмотрим процесс кристаллизации сплава, содержащего 40% N1+60% Сu (сплав .3, рис. 5.4, а). Этот сплав при температуре tо находится в жидком состоянии и обладает двумя степенями свободы (С=К+1—Ф=2+1—1=2), т. е. в определенном интервале можно изменять температуру и концентрацию сплава без изменения числа фаз и равновесия системы. При охлаждении
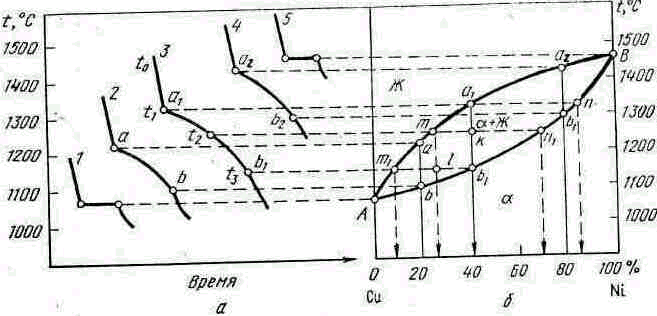

рис. 5.4. Диаграмма состояния II типа (сплавы системы
медь—никель):
а—кривые охлаждения; б—диаграмма состояния; в—
схема структуры твердого а-раствора
сплава до температуры t1 (точка а1) из жидкого сплава начинает выпадать кристалл твердого а-раствора. Для определения состава этих кристаллов необходимо провести через точку а1 (см. рис. 5.4, б) горизонтальную линию до пересечения с линией солидус, в результате чего получаем точку
п, которая фиксирует состав первых кристаллов твердой α-фазы. При температуре t1 и ниже одновременно находятся две фазы при одной степени свободы (С = К+1—Ф ==2+1—2== 1), т. е. с изменением температуры концентрация фаз должна быть определенной.
При понижении температуры до t2 концентрация фаз определится горизонтальной прямой тп1, проведенной до пересечения с линиями солидус и ликвидус. Точка n1 фиксирует концентрацию твердой фазы, а точка т—концентрацию жидкой фазы. При температуре t3 (точка b1), когда затвердевает последняя капля жидкого сплава, концентрация твердой фазы определяется точкой b1 на диаграмме состояния, а жидкой—т1. Линии
а1п, тп1, т1b1 и др., соединяющие составы фаз, находящиеся в равновесии, называют .канодами.
Количественное соотношение фаз или структурных составляющих определяется правилом отрезков, согласно которому в данном сплаве при заданной температуре количество фазовых (или структурных) составляющих прямо пропорционально величине противолежащих отрезков. Например, при температуре t2 (см. рис. 5.4) количество твердой а-фазы в процентах будет равно отношению отрезка kт к длине коноды тп1 или Qα = (kт/тп1) • 100 %, а жидкой фазы Qж= (kп11тп1} • 100 %; соответственно при температуре t3 : Qα = ( m1l/ m1l1) ∙ 100%; Qж = (lb1/m1b1) .100% и т. д.
Таким образом, состав фаз в процессе кристаллизации непрерывно изменяется: жидкой по линии ликвидус, твердой по линии солидус. Выпадающие при разной температуре кристаллы твердого раствора имеют переменный состав: оси кристаллов, выросшие в первый момент кристаллизации, обычно обогащены тугоплавким компонентом, а междуосные пространства заполняются позже и обогащаются более легкоплавким компонентом. Неоднородность отдельных кристаллов сплава называют внутрикристаллической, или дендритной ликвацией. Дендритная ликвация может быть устранена последующим длительным нагревом, обеспечивающим протекание процесса диффузии, выравнивающим состав сплава.
По диаграмме состояния II типа кристаллизуются также сплавы Сu—Аu, Аg—Au, Ni—Аu, Fе—Сг, Fе—Vа, Вi—Sb и др. "
Диаграмма состояния III типа. По этой диаграмме кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, обладают ограниченной растворимостью в твердом состоянии и не образуют химических соединений.
На диаграмме состояния (рис. 5.5, а) кривая АВС—линия ликвидус, выше которой сплав находится в жидком состоянии, а кривая АДВЕС—линия солидус, ниже которой сплав находится в твердом состоянии. По линии АВ кристаллизуются твердый α-раствор (серебро в меди), по линии ВС—твердый β-раствор (медь в серебре). Область АВД— двухфазная, состоящая из кристаллов α и жидкого сплава, а область ВСЕ—из кристаллов β и жидкого сплава. В области АDFА существует твердый α -раствор, а в области СЕGК.С—твердый β-раствор. Взаимная растворимость в твердом состоянии обоих компонентов ограничивается указанными областями, причем при 779 °С предельная растворимость серебра в меди равна 7%, а меди в серебре—8%. При большей концентрации обоих компонентов образуется (по линии DBЕ) эвтектика Э твердых растворов (α + β) предельной концентрации.
Сплав, содержащий 72% Аg и 28 % Сu, при 779 °С кристаллизуется при одновременном выделении кристаллов α и β предельных концентраций, образующих эвтектическую смесь Э(α + β). Сплав, содержащий 80% Сu и 20.% Аu, начинает кристаллизоваться с выделением кристаллов α, а оставшийся жидкий сплав, обогащаясь серебром, стремится к эвтектиче-
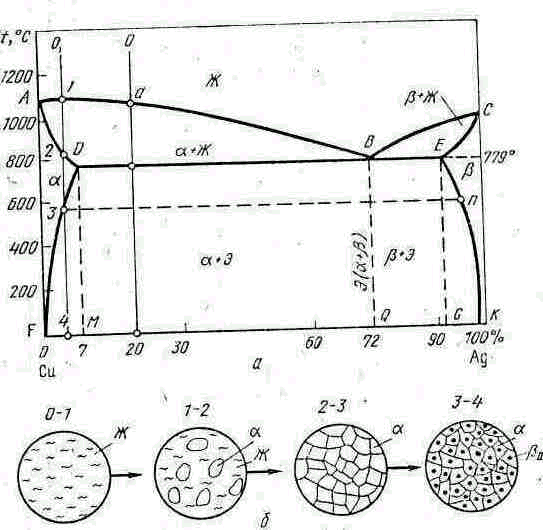
Рис. 5.5. Диаграмма состояния III типа (сплавы системы медь—серебро): а—диаграмма состояния; б—схема кристаллизации сплава, содержащего 95 % Сu и 5 % Аu.
скому составу по линии аВ и при 779 °С затвердевает, образуя эвтектику, которая окружает ранее выпавшие кристаллы α.. Доэвтектические сплавы (область DВQМ} имеют структуру α + Э. Аналогично заэвтектические сплавы (область ВЕGQ) имеют структуру β+Э.
Сплав, содержащий 95 % Сu и 5 % Аu, при 779 °С имеет одну α-фазу ( рис. 5.5,б, точки 2-3). При понижении температуры до точки 3 в нем происходит превращение, связанное с уменьшением предела растворимости серебра в меди. Из α -раствора выделяются кристаллы β концентрации точки n (богатые серебром). Кристаллы, выделяющиеся при вторичной
кристаллизации, обычно обозначают β11, в отличие от первичных кристаллов β, выделяющихся из жидкого сплава. Дальнейшее понижение температуры до точки 4 приводит к полному распаду α-раствора. Линия DF показывает изменение предела растворимости серебра в меди по мере понижения температуры. Структура сплава при температуре выше 100 oС состоит из кристаллов α + β11 (рис. 5.5, б, точки 3—4), а при температуре ниже 100 °С—из кристаллов β11.
Аналогичный процесс вторичной кристаллизации происходит и у сплава, содержащего 5 % Сu и 95 % Аg, только в этом случае из β -раствора выделяются кристаллы α 11, богатые медью. Предел растворимости меди в серебре при понижении температуры изменяется по линии ЕG (от 5 до 1 % Сu). Структура сплава состоит из α + β11.
(α 11 и β11) из эвтектических составляющих обычно не обнаруживается под микроскопом. У некоторых твердых растворов с ограниченной растворимостью предел растворимости одного компонента в другом при понижении температуры не изменяется, в этом случае линии DF или ЕК вертикальные.
По диаграмме состояния III типа затвердевают также сплавы РЬ—5п, Си—Р, Сс1—2п, 5п—8{, А1—И и др.
Диаграмма состояния IV типа.
По этой диаграмме кристаллизуются сплавы, оба компонента которых неограниченно растворимы друг в друге в жидком состоянии, а при затвердевании образуют устойчивое химическое соединение.
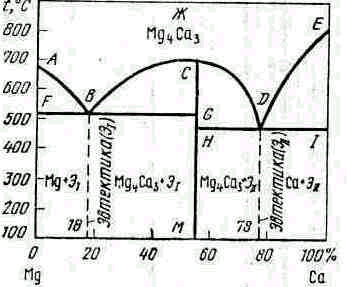
Рис. 5.6. Диаграмма состояния IV типа (сплавы системы Ме—Са)
Диаграмма, состояния сплава магний—кальций приведена на рис. 5.6. Линия СGНМ соответствует химическому соединению Мg4Саз и разделяет диаграмму состояния на две части. Если условно химическое соединение принять за отдельный компонент системы, то диаграмму состояния можно разделить на две диаграммы: Mg-Mg4Ca3 и. Каждая из них представляет собой диаграмму состояния I типа.
Кристаллизация сплавов Mg-Mg4Ca3 начинается по линии АВС и заканчивается на линии FВG при 516 °С. Сплав, кристаллизующийся в эвтектику, содержит около 18 % Са и 82 % Мg. Структура доэвтектических сплавов состоит из кристаллов чистого магния, окруженных эвтектикой (Мg+Э1), а заэвтектических—кристаллов химического соединения Мg4Саз, окруженных эвтектикой ( Мg4Саз +Э1) .
Кристаллизация сплавов Mg4Ca3-Ca протекает аналогично кристаллизации сплавов Мg— Mg4Ca3, с той лишь разницей, что кристаллы Mg4Ca3 начинают выпадать в области СDН, а кристаллы кальция—в области DЕ1. При 462°С затвердевает эвтектика Mg4Ca3-Ca. Доэвтектические сплавы с содержанием 55.. .78 % Са при затвердевании состоят из кристаллов Mg4Ca3, окруженных эвтектикой (Mg4Ca3 +Э11), а заэвтектические с содержанием более 78 % Са состоят из кристаллов чистого кальция, окруженного эвтектикой (Са+ Э11).
По диаграмме состояния IV типа кристаллизуются сплавы Мg—Zn, Мg—Сu, Fе—Zr, Fе—Nb, Мg—Sn и др.
