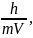- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •12 Строение атома
- •12.1 История развития учения о строении атома
- •12.1.1 Модель атома по Резерфорду
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол – это угол между двумя химическими связями. Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
12.2 Современные представления о строении атома
В 1924 г. Луи де Бройль предположил, что волновыми свойствами должны обладать любые движущиеся материальные частицы, в том числе и электроны.
Объединив уравнения М.Планка (E = h·ν) и А.Эйнштейна (E = mc2), он вывел уравнение для расчета длины волны излучения любой движущейся частицы
λ =
|
(12.2) |
где h – постоянная Планка,
m – масса частицы, V – скорость ее движения.
К 1927 г. были экспериментально (дифракция и интерференция электронов) подтверждены волновые свойства электрона. То есть для описания состояния электрона в атоме необходимо учитывать его волновые свойства. Поэтому можно говорить о вероятности нахождения электрона в определенной области пространства. С учетом этого термин «орбита» был заменен не термин «орбиталь».
Орбиталь – граничная поверхность внутри которой вероятность нахождения электрона составляет 90 %.
В 1925 г. австрийский физик Шредингер предложил для описания состояние электрона в атоме применять математическое уравнение (уравнение Шредингера), учитывающее волновые свойства электрона. Данное уравнение применимо для описания электронной структуры в атоме любого элемента. Решение данного уравнения показывает, что состояние электрона в атоме можно описать посредством четырёх квантовых чисел: главного, орбитального, магнитного и спинового.
Главное квантовое число (n) характеризует радиус и энергию электрона на энергетическом уровне. Оно может принимать целочисленные значения: 1, 2, 3, 4 и т.д. Чем больше n, тем больше радиус и энергия электрона.
Орбитальное квантовое число (l) характеризует энергию электрона на подуровне и форму электронного облака. Оно принимает целочисленные значения от 0 до (n – 1). Например, если главное квантовое число n = 4, то орбитальное квантовое число может принимать значения: 0; 1; 2; 3. Эти значения имеют буквенные обозначения соответственно: s-, р-, d- и f-электронные облака.
Магнитное квантовое число (m) показывает число орбиталей на подуровне и принимает целочисленные значения от –l до +l (всего 2l + 1 значений). На s-, р-, d- и f-подуровнях соответственно находятся 1, 3, 5 и 7 орбиталей.
Спиновое квантовое число (ms) характеризует собственное движение электрона и может принимать два значения: +1/2 и –1/2, то есть на одной орбитали может находиться два электрона.
Принципы заполнения электронных оболочек атомов:
принцип энергетического минимума – заполнение орбиталей происходит в порядке увеличения энергии;
принцип Паули – в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы;
правило Хунда – спин в пределах подуровня должен быть максимален.
В таблице 12.1 приведены значения всех четырех квантовых чисел и максимальные количества орбиталей и электронов на энергетических уровнях и подуровнях.
Таблица 12.1 – Значения n, l, m, количества орбиталей на подуровнях
(2l + 1), электронов на подуровнях (Nl) и уровнях (Nn)
n |
l |
m |
2l + 1 |
Nl = 2(2l+1) |
Nn = 2n2 |
|
|
1 |
0 (s) |
0 |
1 |
2 |
2 |
|
|
2 |
0 (s) |
0 |
1 |
2 |
8 |
|
|
1 (p) |
–1,0,+1 |
3 |
6 |
|
|||
3 |
0 (s) |
0 |
1 |
2 |
18 |
|
|
1 (p) |
–1,0,+1 |
3 |
6 |
|
|||
2 (d) |
–3, –2, –1,0,+1,+2 |
5 |
10 |
|
|||
4 |
0 (s) |
0 |
1 |
2 |
32 |
|
|
1 (p) |
–1, 0, +1 |
3 |
6 |
|
|||
2 (d) |
–2, –1, 0, +1, +2 |
5 |
10 |
|
|||
3 (f) |
–3, –2, –1,0,+1,+2,+3 |
7 |
14 |
|
|||
|
|
||||||
Для описания состояния электронов в атоме применяются: электронная формула, энергетическая диаграмма, геометрическая модель.
Электронная формула показывает распределение электронов по
энергетическим уровням и подуровням. Например:
для кислорода (О) элемента с порядковым номером 8 – 1s22s22p4,
для хрома (Cr) элемента с порядковым номером 24 – 1s22s22p63s23p63d44s2, с учетом проскока электрона электронная формула имеет вид 1s22s22p63s23p63d54s1. Проскок электронов объясняется тем, что наполовину или полностью заполненные подуровни (р3, р6, d5, d10, f7, f14) характеризуются повышенной устойчивостью.
Энергетическая диаграмма графически показывает распределение электронов по энергетическим ячейкам (орбиталям). Стрелка условно обозначает электрон и его спин. На рисунке12.2 показана энергетическая диаграмма атома кислорода.
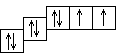
1s2 2s2 2p4
Рисунок 12.2 – Энергетическая диаграмма атома кислорода
Геометрическая модель показывает формы орбиталей и их расположение в пространстве. На рисунке12.3 показана геометрическая модель атома кислорода.
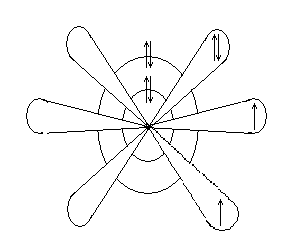
Рисунок 12.3 – Геометрическая модель атома кислорода
Электронную формулу элемента можно записать на основании его положения в периодической таблице, так как периодичность изменения свойств элементов в таблице являются следствием периодичности заполнения электронами энергетических уровней и подуровней атомов.