- •Содержание
- •2 Лабораторные работы
- •2. 1 Титриметрический анализ, химическая посуда
- •Способы выражения концентрации растворов
- •Химическая посуда
- •Контрольные вопросы:
- •2. 2 Дисперсные системы и электрокинетические явления
- •Двойной электрический слой.
- •Электрокинетические явления.
- •Цель работы.
- •Приборы и реактивы
- •Выполнение работы.
- •Обработка результатов.
- •Контрольные вопросы.
- •2. 3 Коагуляция и седиментация.
- •Цель работы:
- •Приборы и реактивы
- •Выполнение работы.
- •Обработка результатов.
- •Контрольные вопросы.
- •2. 4 Определение критической концентрации мицеллообразования. Поверхностно-активные вещества, классификация.
- •Адсорбция на границе раздела фаз.
- •Мицеллообразование
- •Гидрофильно-липофильный баланс
- •Солюбилизация.
- •Методы определения ккм
- •Цель работы:
- •Приборы и реактивы:
- •Выполнение работы
- •Обработка результатов
- •Контрольные вопросы.
- •2. 5 Расчет параметров кристаллической решетки сдг
- •Цель работы:
- •Выполнение работы
- •Обработка результатов
- •Контрольные вопросы.
- •3 Примеры решения задач по теме «Неорганические мицеллы»
- •3.1 Задачи на выпадение осадка (Произведение растворимости)
- •3.2 Задачи на определение формулы мицеллы
- •3.3 Задачи для самостоятельного решения:
- •4 Темы для самостоятельного изучения
- •4.1 Адсорбция.
- •Уравнение изотермы адсорбции Ленгмюра (Лэнгмюра)
- •Уравнение изотермы адсорбции Фрейндлиха
- •Теория полимолекулярной адсорбции Поляни (1915)
- •Уравнение изотермы адсорбции бэт
- •Контрольные вопросы.
- •4.1 Анализ твердой поверхности на содержание кислотно-основных центров
- •Контрольные вопросы:
- •4.3 Жидкие кристаллы
- •Контрольные вопросы:
- •5 Вопросы к аттестационному тестир
- •5.1 По предмету «Физикохимия наночастиц и наноматериалов»
- •5.2 По предмету «Физикохимия наноструктурированных материалов»
- •Приложение Лабораторный журнал
4 Темы для самостоятельного изучения
4.1 Адсорбция.
Свойства участка фазы, примыкающего к поверхности раздела фаз, отличаются от свойств фазы в объеме: фактически частицы, находящиеся на поверхности каждой фазы, образуют особую поверхностную фазу, свойства которой существенно отличаются от свойств внутренних областей фазы. Частицы, расположенные на поверхности, находятся в другом окружении по сравнению с частицами, находящимися в объеме фазы, те взаимодействуют как с однородными частицами, так и с частицами другого рода. Следствием этого является то, что средняя энергия частицы, находящейся на поверхности раздела фаз отличается от средней энергии такой же частицы в объеме фазы (причем энергия частицы на поверхности может быть как больше, так и меньше энергии частицы в объеме). Поэтому важнейшей характеристикой поверхностной фазы является поверхностная энергия Gs.
Для характеристики поверхности раздела, отделяющей одну фазу от другой, вводится понятие поверхностное натяжение σ – отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз. Как и поверхностная энергия фазы поверхностное натяжение может иметь как положительное, так и отрицательное значение Поверхностное натяжение положительно, если находящиеся на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чем с частицами другой фазы. Согласно принципу минимума свободной энергии, любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию; поэтому в случае положительного поверхностного натяжения фаза стремится уменьшить свою поверхность.
На границе конденсированной (т.е. твердой или жидкой) фазы с газом поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг с другом сильнее, чем с молекулами газа. Результатом уменьшения поверхностной энергии служит либо уменьшение площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшение поверхностного натяжения при появлении на поверхности раздела фаз новых частиц – молекул газа либо растворенного вещества.
Процесс поглощения одним веществом других веществ называется сорбцией. Обратный процесс называется десорбция. Сорбция в толще поглотителя (в объеме) называется абсорбцией. Повышение концентрации газообразного или растворенного вещества на поверхности раздела фаз, например, на поверхности раздела твердое тело – газ, твердое тело – раствор, жидкость – газ (воздух) называется адсорбцией. Вещество, на поверхности которого происходит адсорбция называется адсорбентом, поглощаемое вещество, газ или растворенное вещество ещё находящееся в объёме фазы, называют адсорбтив, поглощённое – адсорбат.
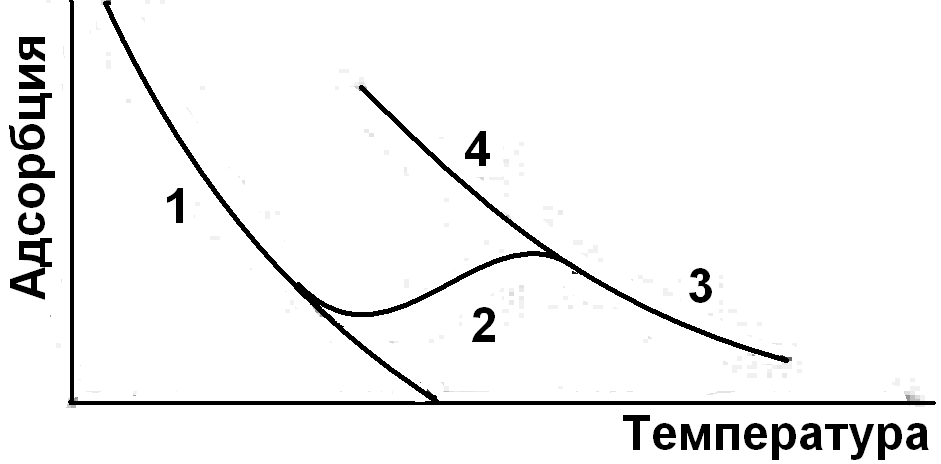
Различают физическую адсорбцию, когда частицы адсорбированного вещества не образуют химических связей с адсорбентом, и хемосорбцию, когда адсорбционные силы имеют химическую природу. Хотя существуют и промежуточные формы. В процессе физической адсорбции молекулы связываются с поверхностью силами Ван-дер-Ваальса, при химической (хемосорбции) – силами химического взаимодействия. Физическая сорбция обратима, в то время как хемосорбция может быть и необратимой. Кроме того, значения теплот хемосорбции, характеризующие силу связи молекулы с поверхностью, значительно выше (единицы и десятки кДж/моль) по сравнению с физической сорбцией (доли и единицы кДж/моль). Повышение температуры может переводить частично физическую сорбцию в хемосорбцию, если тепловая энергия превышает энергию активации такого процесса (рис. 1).
|
Рис. 1. Адсорбция молекул гaзa на поверхности твердого теля. Переход от физической сорбции (1) к хемосорбции (2) при повышении температуры; (3,4) – новая изобара адсорбции |
Адсорбция определяется природой поглощаемого вещества и поглотителя, ее величина зависит от температуры, давления поглощаемого газа, концентрации раствора, из которого осуществляется адсорбция. Количество адсорбированного вещества пропорционально площади поверхности тела. Поэтому вещества в мелкораздробленном состоянии, имея большую поверхность, обладают значительной адсорбционной способностью. К эффективным адсорбентам можно отнести уголь, силикагель, глину, каолин, а также целлюлозу, фильтровальную бумагу, хлопчатобумажную ткань, натуральный шелк, шерсть и другие материалы.
Зависимость адсорбции от давления газа (его концентрации) или содержания адсорбируемого вещества в растворе при данной температуре может выражаться уравнением адсорбции (изотермой адсорбции).
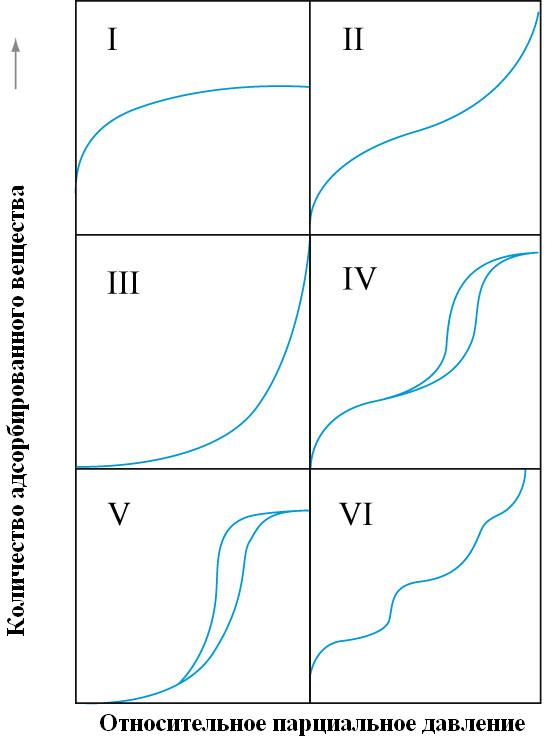
Большинство изотерм физической адсорбции можно отнести к одному из пяти типов, по классификации, впервые предложенной С. Брунауэром, Л. Демингом, У. Демингом. и Э. Теллером (БДДТ).
|
Рис. 2. Основные типы изотерм адсорбции по классификации БДДТ.
Тип I. Изотерма описывается теорией монослоя и уравнением Ленгмюра. Тип II. Наиболее общий тип изотермы, соответствующий формированию полислоя. Тип III. Сравнительно редко встречающийся тип изотерм образования полислоя из газовой среды на твердом адсорбенте, для тел, потенциал монослоя которых мал и имеет тот же порядок, что и теплота конденсации адсорбтива. |
Типы IV и V аналогичны типам II и III и характерны для пористых сорбентов, где адсорбция ограничивается объемом мезопор (2-50 нм), а предельная адсорбция достигается при давлениях Р/Рs<<1. Петля гистерезиса указывает на дополнительное поглощение пара в результате капиллярной конденсации.
Изотермы типа VI характерны для непористых адсорбентов с однородной поверхностью