
- •Практикум
- •1 Мета і задачі практичних занять
- •2 Вміст практичних занять
- •1.1 Розрахунок витратних коефіцієнтів
- •1.2 Приклади розв’язку задач
- •1.3 Задачі для самостійного розв’язку
- •2.1 Основи технологічних розрахунків – закони збереження і стехіометричних співвідношень
- •2.2 Приклади розв’язку задач
- •2.3 Задачі для самостійного розв’язку
- •Тема 3 Матеріальні розрахунки хіміко-технологічних процесів. Складання матеріальних балансів
- •3.2 Приклади розв’язку задач
- •3.3 Задачі для самостійного розв'язання
- •4.1 Теплові розрахунки хіміко-технологічних процесів. Складання теплових балансів
- •4.2 Приклади розв’язку задач
- •4.3 Задачі для самостійного розв'язання
- •Тема 5 Хімічна рівновага. Розрахунки рівноважних виходів
- •5.1. Розрахунок рівноважного складу суміші для хімічних процесів, які супроводжуються одною оборотною реакцією
- •5.1.1 Приклади розв’язку задач
- •5.1.2 Задача для самостійного розв'язання
- •5.2 Розрахунок рівноважного складу суміші для хімічних процесів, що супроводжуються декількома паралельними або послідовними оборотними процесами
- •5.3 Задачі для самостійного розв’язання
- •Тема 6 Кінетика хіміко-технологічних процесів. Розрахунок кінетичних параметрів
- •6.1 Розрахункові формули швидкості процесів.
- •6.2.Розрахунок кінетичних параметрів.
- •6.2.1.Методи визначення порядку реакцій.
- •6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
- •6.2.1.2. Метод Оствальда-Нойеса.
- •6.2.1.3. Універсальний метод визначення порядків реакцій.
- •6.2.2. Константи швидкості, передекспоненціальний множник, енергія активації.
- •6.3 Задачі для самостійного вирішення
- •7.1 Розрахунок гетерогенно-каталітичних процесів
- •7.1 Основні формули для розрахунку гетерогенно-каталітичних реакцій
- •7.2 Розрахунки каталітичних процесів і реакторів.
- •7.3 Задачі для самостійного рішення
- •Тема 8 Електрохімічні процеси
- •8.2 Приклади розв’язку задач
6.2.Розрахунок кінетичних параметрів.
До основних параметрів кінетики хімічних перетворень відносяться константа швидкості, порядок, енергія активації процесу.
6.2.1.Методи визначення порядку реакцій.
При вивченні кінетики хімічних реакцій часто доводиться визначати порядок реакції по тих або інших компонентах або порядок реакції в цілому. Із співвідношень формальної кінетики можна визначити, чи протікає реакція за законом першого, другого або третього порядку. Для цього необхідно послідовно підставляти експериментальні дані в співвідношення, виведені для реакцій різних порядків, і вибирати, яке з них виконується. Проте, цей прийом нічого не дає у випадку, якщо реакція багатостадійна і порядок сумарної реакції перевищує третій або є дробовим. Приведемо деякі методи, що дозволяють безпосередньо визначити порядок реакції.
6.2.1.1. Визначення порядку реакції по періоду напіврозпаду (тобто часу, протягом якого концентрація реагуючої речовини зменшиться удвічі).
Цей метод застосовується, якщо кінетичне рівняння має вигляд:
![]()
Для
реакцій різних порядків залежність
часу напівперетворення
![]() 0,5
від
початкової концентрації реагуючих
речовин різна.
0,5
від
початкової концентрації реагуючих
речовин різна.
Для

при = 0,5
![]() .
.
Таким чином, якщо в дослідах з різною початковою концентрацією 0,5 постійне, то рівняння кінетики – першого порядку.
Для
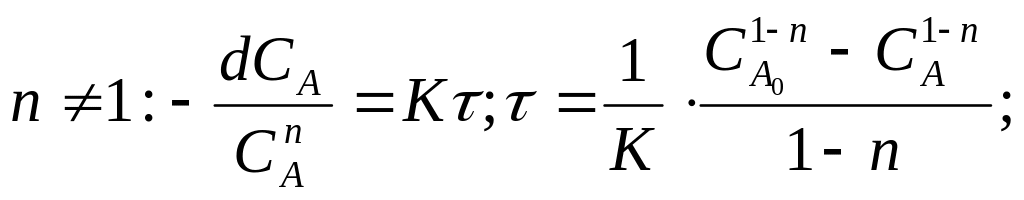
При
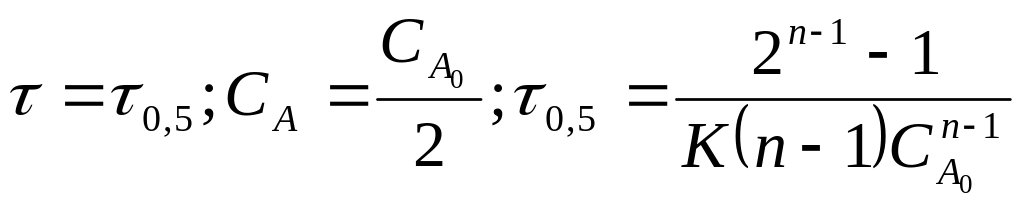
Реалізовуючи
два досліди при![]() ,
одержимо:
,
одержимо:
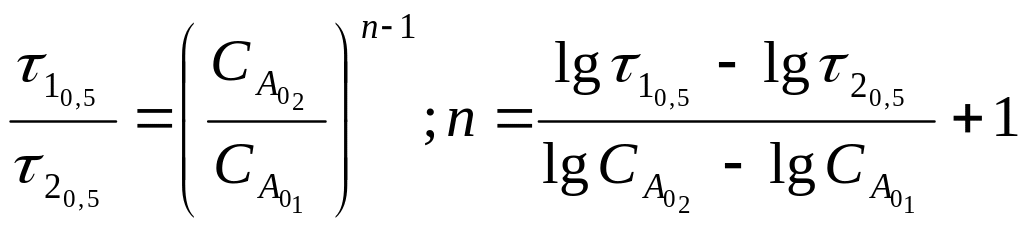 (6.29)
(6.29)
6.2.1.2. Метод Оствальда-Нойеса.
Цей метод застосовується для визначення порядку реакції по відношенню до кожної з реагуючих речовин. Для визначення, наприклад, порядку по речовині А в реакції (6.5) необхідно створити такі умови, при яких змінюватиметься концентрація тільки речовини А. це досягається, якщо узяти концентрацію речовини В у великому надлишку. В цьому випадку рівняння (6.5) матиме вигляд:
![]()
Проводячи два досліди з різними початковими концентраціями речовини А (метод Вант-Гоффа), одержимо:
 (6.30)
(6.30)
Аналогічно поступають для визначення порядку по речовині В.
Цей метод володіє тим недоліком, що при дуже великому надлишку (або недостатку) одного з компонентів можливе протікання побічних реакцій. Наприклад, протікання основної реакції СО+H2O=CO2+H2 при надлишку СО (для визначення порядку по H2O) супроводжується виділенням вуглецю.
6.2.1.3. Універсальний метод визначення порядків реакцій.
Якщо
при одній і тій же температурі визначити
для хімічної реакції aA+bB>dD її швидкість
і для двох випадків, при яких
![]() ,
але
,
але
![]()
![]() і
і
![]()
![]() ,
то з рівняння (6.7):
,
то з рівняння (6.7):
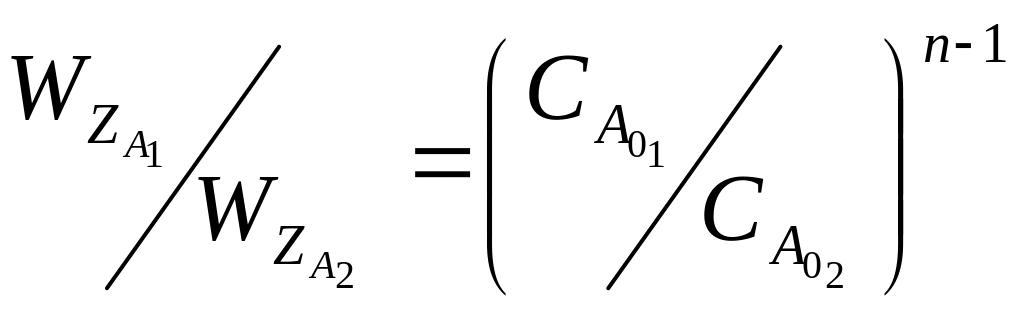 (6.31)
(6.31)
і логарифмуванням цього рівняння можна визначити сумарний порядок n.
Якщо
визначити швидкість реакції для двох
випадків, при яких
 (6.32)
(6.32)
звідки легко визначити порядок по компоненту В. Порядок по компоненту А буде рівний nA=n-nB.
Таким чином, в даному випадку для визначення кінетичних порядків реакції достатньо провести 3 серії дослідів за вищезгаданих умов.
