
104. Решение
Электролитической диссоциацией называют процесс распада молекул на ионы под действием растворителя. Вещества, молекулы которых подвергаются диссоциации, называются электролитами. Количественная характеристика диссоциации электролитов называется степенью диссоциации (α); для электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах. Степень диссоциации (α) отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N). Константа равновесия для процесса диссоциации называется константой диссоциации (K). В общем случае для электролита, диссоциирующего на два иона: АВ А+ + В–
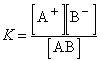
Существует 4 современных теории кислот и оснований:
Теория Аррениуса (теория электролитической диссоциации)
Теория Брёнстеда (протонная теория)
Теория кислот и оснований Льюиса (электронная или апротонная теория)
Теория Усановича
Согласно теории электролитической диссоциации, кислоты электролиты, которые при диссоциации в водных растворах, в качестве катионов дают только катионы водорода (гидроксония-Н3О+) и анионы кислотного остатка.
Основания электролиты, которые при диссоциации в водных растворах в качестве анионов дают только анионы гидроксила (ОН–) и катионы. Согласно протонной теории кислота это водородсодержащая частица вещества (молекула или ион), способная быть донором протона, а основание это частица вещества, способная быть акцептором протона. Кислоты и основания как вещества, теряющие и приобретающие протоны, называются протолитами.
Na2SO3 + 2HCl 2NaCl + SO2 + H2O
2Na+ + SO32 + 2H+ + 2Cl 2Na+ + 2Cl + SO2 + H2O
SO32 + 2H+ SO2 + H2O
Соль образована слабой кислотой и сильным основанием, гидролиз по аниону, щелочная среда.
в молекулярной форме: CH3COONa + H2O CH3COOH + NaOH
CH3COONa CH3COO– + Na+
H2O H+ + OH–
в полной ионной форме: CH3COO– + Na+ + H2O CH3COOH + Na+ + OH–
в сокращенной ионной форме: CH3COO– + H2O CH3COOH + OH–
Соль образована сильной кислотой и слабым основанием, гидролиз по катиону, кислая среда.
AlCl3 Al3+ + 3Cl
H2O H+ + OH–
Первая ступень:
а) Al3+ + HOH AlOH2+ + H+
б) Al3+ + 3Сl– + H2O AlOH2+ + 2Сl– + H+ + Сl–
в) AlCl3 + H2O AlOHCl2 + HCl
Вторая ступень:
а) AlOH2+ + H2O Al(OH)2+ + H+
б) AlOH2+ + 2Сl– + H2O Al(OH)2+ + Сl– + H+ + Сl–
в) AlOHCl2 + H2O Al(OH)2Cl + HCl
Реакция по третьей ступени практически не протекает. Ввиду накопления ионов водорода процесс смещается в сторону исходных веществ. Однако разбавление раствора и повышение температуры усиливают гидролиз. Поэтому может происходить гидролиз и по третьей:
Al(OH)2Cl + H2O Al(OH)3 + HCl
3) Соль образована слабой кислотой и слабым основанием, гидролиз по аниону и катионы (полный гидролиз), в этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
CuS Cu2+ + S2
H2O H+ + OH–
CuS + 2H2O Cu(OH)2 + H2S
