
- •Механіка
- •Молекулярна фізика
- •10.1. Перше начало термодинамiки. Поняття функції стану I функціоналу. Робота газу при рiзнux процесах.
- •12.1. Рівняння стану реального газу. Ізотерми реального газу.
- •Електрика та магнетизм
- •17.1. Електричне поле. Напруженість електричного поля. Теорема Остроградського-Гаусса. Різниця потенціалів. Зв’язок між напруженістю та різницею потенціалів.
- •10.2. Дифракція на багатомірних гратках. Дифракція рентгенівських променів. Методи рентгеноструктурного аналізу.
- •12.2. Закони теплового випромінювання. Індуковане випромінювання. Лазери.
- •Фізика атома і атомних явищ
- •Фізика ядра та елементарних частинок
- •10.3.Бета-розпад. Види Бетарозпаду. Енергетичнi спектри електронiв. Експерuментальний доказ iснування нейтрино.
- •11.3. Космічні промені. Первинне космічне випромінювання. Проходження космічного випромінювання крізь атмосферу.
- •Теоретична фізика
Фізика атома і атомних явищ
1.Аномальний ефект Зеємана.
Розрізняють два ефекти Зеємена: 1) нормальний – розщеплення синглета на три триплета; 2) аномальний – розщеплення більш ніж на три лінії в магнітному полі.
Ці
ефекти пояснив Лоренц:
кожний стан володіє механічним моментом
 .
В магн. полі атоми з магнітним моментом
отр. додаткову Е
.
В магн. полі атоми з магнітним моментом
отр. додаткову Е
 ;
;
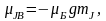

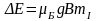
Таким
чином в магн. полі енергетичний рівень
розщеплюється на 2J+1
рівень, віддалених енергетичних рівнів
у відповідності із значенням числа
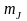
Зобразимо розщеплення Na дуплета
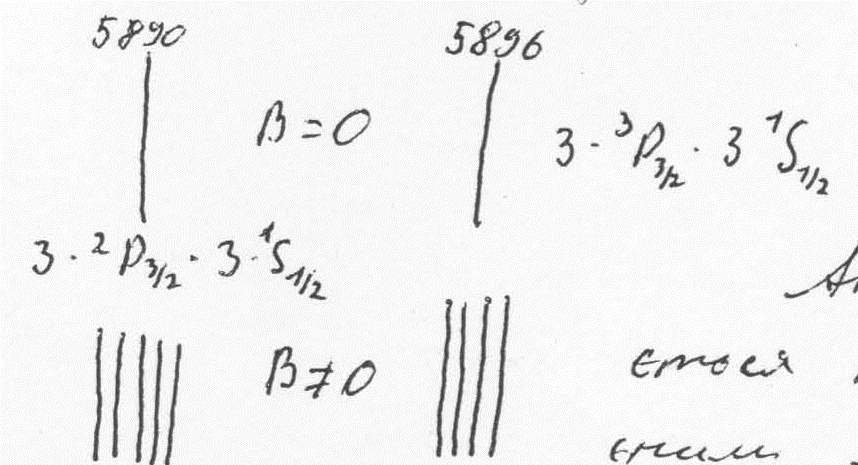
Аномальний
ефект Зеємана
пояснюється наявністю спіна електрона
і його подвоєним магнетизмом. В магн.
полі терм отр. Е
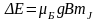 .
Визначимо фактор
Ланде g
для
S
i
P
– термів.
.
Визначимо фактор
Ланде g
для
S
i
P
– термів.
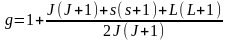
 м
L=0,
S=½,
J=½.
Для
цього терма g=2
м
L=0,
S=½,
J=½.
Для
цього терма g=2
 L=1,
S=½,
J=½.
Для цього терма g=2/3
L=1,
S=½,
J=½.
Для цього терма g=2/3
В
магн. полі Е
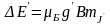 ,
,
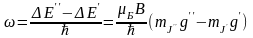
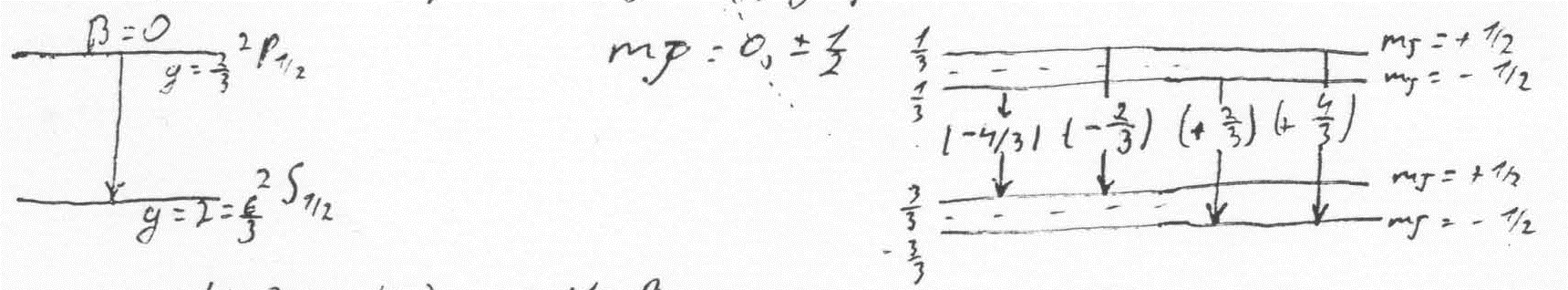
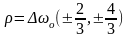 ,
,
Таким
чином наявність спіна і його магнетизму
пояснює і аномальний ефект Зеємана,
який має місце при дуже сильних магн.
полях, коли дія зовнішнього поля слабша
за - орбітальну взаємодію. В сильних
магн. полях зв’язок між орбітальним і
власним моментом розривається і вони
проектуються на напрям магнітного поля
окремо, незалежно. В цьому випадку зміна
енергетичних рівнів (терма) буде
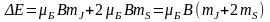 причому
для mJ
i
ms
є правило відбору:
причому
для mJ
i
ms
є правило відбору:
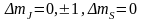 тобто
у випадку сильного магн. поля отр.
нормальний ефект Зеємана
(триплет).
Цей ефект наз. ефектом Пашена-Бака.
тобто
у випадку сильного магн. поля отр.
нормальний ефект Зеємана
(триплет).
Цей ефект наз. ефектом Пашена-Бака.
2.Досліди Штерна-Герлаха. Спін електрона.
В 1925 р була ств. гіпотеза про те, що валентний електрон лужного металу володіє ще одним квантовим числом – власним механічним моментом.
Розглянемо досліди Штерна і Герлаха в якому доказано, що існування спіну електрона і його просторове квантування. В досліді “холодний” атомарний водень (min енергія) пропускається через сильно неоднорідне магн. поле з індукцією В яке ств. постійним магнітом.
 1S-
min
енергія l=0;
ML=h√
L
(L
+1)=0;
1S-
min
енергія l=0;
ML=h√
L
(L
+1)=0;
µL/ML = -e/2mc; µL =0
Основний вклад в момент атоми вносить власний момент електрона. Холодний H2 не виділяється, якщо він володіє тільки орбітальним моментом.
Дослід показує, що електрон володіє власним механічним моментом з яким зв’язаний магн. момент. Той факт, що пучок розщеплюється на 2 свідчить про те, що власний момент електрона має лише два напрямки в просторі тобто просторове квантування існує. Власний механічний момент визначається за квантовими законами. Ms =h √S(S +1) S- cпінове квантове число, його проекція на заданий напрямок Ms =± ms h приймає 2S+1 значень. З дослідів Штерна і Герлаха 2S+1=2; S=1/2, Мs =h √1/2(1/2+1) = √3/2h,
msh = +1/2, -1/2. Відношення магн. до механічного µs /Ms =-e/mc;
µS = -eh/mc√ S (S+1) велична
µ S = -2µ√ S(S+1); µL = -eh/mc;
В зв’язку з тим, що S= ½ говорять, що володіє пів-цілим спіном, атом ядра з непарною кількістю нуклонів. Ядра з парною к-тю нуклонів мають цілий S=1. Так як власний магн. момент
µL = -2 S √δ(S+1); а µL = µв √L (L+1) говорять що спін володіє подвоєним магнетизмом. Магнетон Бора виступає в ролі природної одиниці магн. моменту електрона. Пояснимо на основі спіну розщеплення енергетичних рівнів. Електрон володіє орбітальним і власним моментами які утв. результуючий механічний момент електрона який визначається за квантовими законами µj =h √J(J+1), J- результуюче квантове число, що визначає величину результуючого механічного моменту електрона. J – може приймати значення J= L + s, L + s-1 | L - s|.
Для S-термів L =0, S=1/2, J=1/2 ;P- термів L =1, S=1/2, J= 3/2, 1/2
d- термів L =2, S= 1/2, J= 5/2, 3/2
Для Р, d термів результуюче квантове число приймає два значення, це означає що орбітальний і власний механічний моменти в цих станах по різному орієнтовані один відносно одного. З механічним моментом електрона зв’язані магн. моменти. Від їх орієнтації залежить Е взаємодії системи і атома. Терми які мають різні J мають різну Е.
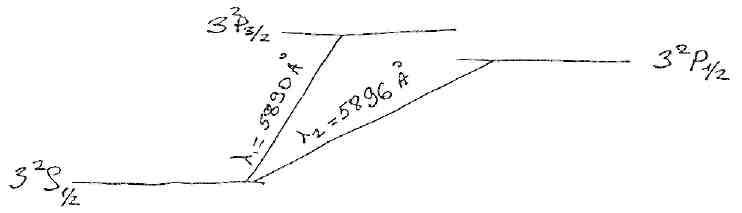
Чим більше J тим ,більша Е терму. Взаємодія власного і орбітального моментів наз. спін-орбітальною взаємодією, яка приводить до розщеплення енергетичних рівнів. Терми металів позначають 2 Sj=1/2 , 2P3/2 , 2P1/2 , 2D5/2 , 2D3/2 , 2F7/2 , 2F5/2
2 – мультиплетність. Тоді резонансна лінія головної орбіти атома зображується:
3.Розподіли Максвелла-Больцмана, Фермі-Дірака, Бозе-Ейнштейна.
Розподіл Максвела-Больцмана стосується ідеального газу.
Будемо виходити з канонічного розподілу Гіббса:
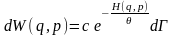 (1)
(1)
Для ідеального газу функція Гамільтона може бути представлена у вигляді суми функцій Гамільтона і-ої частки:
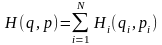 (2)
→ (1)
(2)
→ (1)
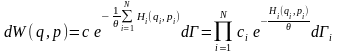 (3)
(3)
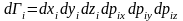 (4)
(4)
Для окремо взятої частки можна записати:
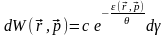 (5)
(5)
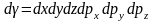 (6)
(6)
 (7)
– функція Гамільтона однієї частки
ідеального газу. Отже, ймовірність
координат та імпульсів частки ідеального
газу є незалежними подіями.
(7)
– функція Гамільтона однієї частки
ідеального газу. Отже, ймовірність
координат та імпульсів частки ідеального
газу є незалежними подіями.
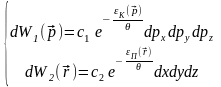 (8)
(8)
(5),(8) – розподіл Максвела-Больцмана для ідеального газу.
Константу с в (5) знайдемо з умови нормування:
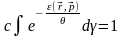 (9)
(9)
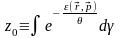 (10)
– статистичний інтеграл 1 частки
ідеального газу
(10)
– статистичний інтеграл 1 частки
ідеального газу
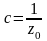 (11)
(11)
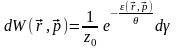 (12)
дає ймовірність того, що координати та
імпульси 1 частки ідеального газу лежать
в границях {x;
x+dx,
y;y+dy,
z;
z+dz},{px;
px+dpx,
py;
py+dpy,
pz;
pz+dpz}
(13).
(12)
дає ймовірність того, що координати та
імпульси 1 частки ідеального газу лежать
в границях {x;
x+dx,
y;y+dy,
z;
z+dz},{px;
px+dpx,
py;
py+dpy,
pz;
pz+dpz}
(13).
Число часток ідеального газу, координати та імпульси яких лежать в границях (13):
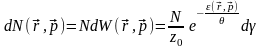 (14)
(14)
Для
ідеального газу
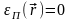 .
Запишемо розподіл (14) для певного
мікростану.
.
Запишемо розподіл (14) для певного
мікростану.
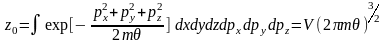 (15)
(15)
В силу співвідношення Гейзенберга одному мікростану відповідає елемент об’єму фазового простору dГ=h3.
Запишемо середнє число часток, які знаходяться в і-му квантовому стані з енергією εі в об’ємі фазового простору dГ=h3:
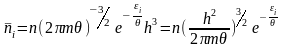 (16)
(16)
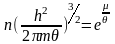 (17)
(17)
μ – хімічний потенціал системи
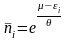 (18)
– класична функція розподілу
Максвела-Больцмана для і-го мікростану
системи ідеального газу.
(18)
– класична функція розподілу
Максвела-Больцмана для і-го мікростану
системи ідеального газу.
Розглянемо ідеальний газ, який описується законами квантової механіки. Для чисел заповнення квантових станів повинна виконуватися умова:
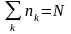 (19)
(19)
Для
ідеального газу числа заповнення можуть
змінюватися. Для ферміонів в силу
принципу Паулі nk=0;
1. Для
бозонів nk=0;
1;
2;... Важливою характеристикою є середнє
число заповнення в k-му
квантовому стані. Для обчислення
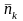 використаємо великий канонічний
розподіл, для якого не виконується умова
(19).
використаємо великий канонічний
розподіл, для якого не виконується умова
(19).
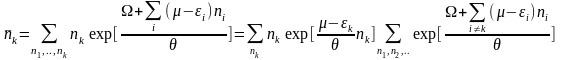 (20)
(20)
Використаємо умову нормування великого канонічного розподілу:
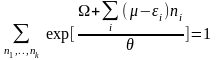 (21)
(21)
 (22)
(22)
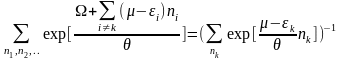 (23)
→ (20)
(23)
→ (20)
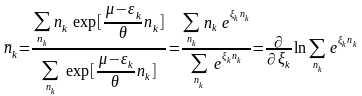 (24)
(24)
Розглянемо ферміони.
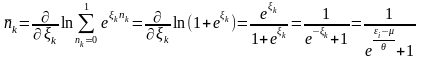 (25)
– функція Фермі-Дірака для квантового
ідеального газу.
(25)
– функція Фермі-Дірака для квантового
ідеального газу.
Розглянемо бозони.
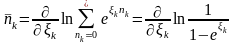 (26)
(26)
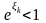 -
знаменник збіжної геометричної прогресії.
-
знаменник збіжної геометричної прогресії.
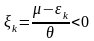 (27)
(27)
При εmin=0 μ<0, тобто хімічний потенціал бозонів від’ємний.
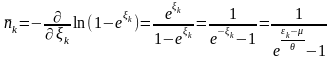 (28)
– функція розподілу Бозе-Ейнштейна.
(28)
– функція розподілу Бозе-Ейнштейна.
4.Експериментальні дані про властивості складних атомів. Структура атомів лужних металів, валентні електрони, дублетна структура цих атомів. Спіни електронів.
Складними називаються атоми, які мають два і більше електронів. Розглянемо основні властивості складних атомів на прикладі лужних металів, на зовнішній оболонці яких є один валентний електрон.
Спектри лужних металів складаються із серій, найбільш інтенсивними з яких є головна, різка, дифузійна і фундаментальна. Наявність серій говорить про те, що атоми лужних металів володіють дискретними енергетичними станами, при переході між якими виникають спектральні закономірності. Зобразимо енергетичну діаграму атома натрію.
L 0(S) 1(Р) 2(D) 3(F)
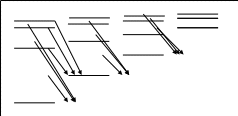 n
n
6
5
4
фундаментальна
різка дифузійна
3
Е головна
Енергетична діаграма Na дуже подібна до енергетичної діаграми Н. Відмінність полягає в тому, що енергетичні стани з різним значенням квантового числа L мають різну енергію. При одному і тому ж n з ростом L зростає енергія.
Орбітальний момент атома визначається орбітальним моментом його зовнішнього валентного електрона. Тоді ця енергетична діаграма є енергетичною діаграмою валентного електрона атома Na, основним станом якого є стан 3S.
Оптичні дослідження іонів лужних металів показують, що момент імпульсу атомного залишку (ядро і всі електрони, крім валентного) дорівнює нулю. Переходи валентного електрона призводять до появи спектральних закономірностей.
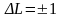 (1)
– правило відбору.
(1)
– правило відбору.
Ридберг встановив явний вигляд спектральних термів для лужних металів:
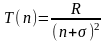 (2)
(2)
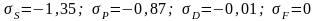 -
поправки Ридберга.
-
поправки Ридберга.
Валентний
електрон атома Na
рухається не в полі ядра, а в узагальненому
полі ядра й електронів атомного залишку.
Таке поле не є кулонівським, тобто не
пропорційне
 ,
але, оскільки швидкість електрона в
атомі дуже велика, поле залишається
центральносиметричним. Власні функції,
які є рішенням рівняння Шредінгера,
отримуються при власних значеннях
енергії Еnl
і залежать не тільки від головного
квантового числа, а й від орбітального
квантового числа. Отже, знімається
виродження по орбітальному квантовому
числу, тобто стани з різним L
мають різні значення енергії.
,
але, оскільки швидкість електрона в
атомі дуже велика, поле залишається
центральносиметричним. Власні функції,
які є рішенням рівняння Шредінгера,
отримуються при власних значеннях
енергії Еnl
і залежать не тільки від головного
квантового числа, а й від орбітального
квантового числа. Отже, знімається
виродження по орбітальному квантовому
числу, тобто стани з різним L
мають різні значення енергії.
При дослідженні спектрів лужних металів було встановлено, що кожна лінія кожної серії складається з двох ліній. Структура спектральної лінії, яка відображає розкладення спектральної лінії на компоненти, називається тонкою структурою спектрів і відображає мультиплетність спектру.
Резонансна лінія головної серії спектру Na (3Р→3S) складається з двох ліній: λ1=5890Å; λ2=5896Å.
Лінії різкої серії мають однакове розщеплення, а лінії інших серій – різні. Таке розщеплення ліній може бути викликане розщепленням спектральних рівнів.
Це
стало підставою для гіпотези, що валентний
електрон бере участь ще в якомусь русі,
тобто володіє ще одним числом. В 1935 р.
Уленбек і Гоупсмітт спеціально для
пояснення тонкої структури припустили,
що електрон володіє, окрім орбітального
моменту руху, власним механічним моментом
імпульсом (спіном):
 .
Цей момент не зв’язаний з орбітальним
рухом електрона навколо власної осі,
оскільки:
.
Цей момент не зв’язаний з орбітальним
рухом електрона навколо власної осі,
оскільки:
Вимірювання показують, що відношення власного магнітного моменту до власного механічного моменту електрона вдвічі більше за гіромагнітне відношення.
Точка на „екваторі” електрона обертається з лінійною швидкістю більшою за швидкість світла.
Отже, спін – це внутрішня властивість електрона.
В 1925 р. Штерн і Герлах провели дослід (пропускання атомів водню з мінімальною енергією через сильне неоднорідне поле), в якому експериментально довели існування спіну.
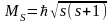 (3)
(3)
s – спінове квантове число; s=1/2.
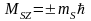 (4)
(4)
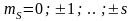 -
магнітне
квантове число, яке приймає (2s+1)=2
значення.
-
магнітне
квантове число, яке приймає (2s+1)=2
значення.
Електрон в атомі володіє орбітальним і власним моментами імпульсу, які утворюють результуючий момент імпульсу:
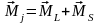 (5)
(5)
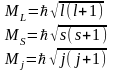 (6)
(6)
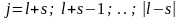 -
результуюче квантове число.
-
результуюче квантове число.
Однакове розщеплення ліній різкої серії свідчить про те, що S-терми не розщеплюються (синглетні).
Величина квантового числа j залежить від орієнтації векторів орбітального та власного моментів, з якими зв’язані їх магнітні моменти, енергія взаємодії яких залежить від їх орієнтації (спін-орбітальна взаємодія). За рахунок цієї взаємодії всі терми, крім S-термів, розщеплюються на два терми з різним значенням j: 2S1/2; 2P1/2; 2P3/2; 2D3/2; 2D5/2; …
Розщеплення:
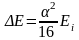 (7)
(7)
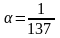 -
постійна тонкої структури
-
постійна тонкої структури

5.Спектри гелію. Ортогелій і парагелій. Принцип Паулі.
Аналіз спектра Не показує, що існують дві системи енерг. рівнів його атомів: в одній з них кожний рівень поодинокий, в другій - становить сукупність 3 дуже близьких рівнів.
У нормальному стані головне квантове число атома Не п приймає значення n1=n2=1, так що орбітальний момент електронів l1=l2=0. Отже, нормальний стан є S-станом (L=0). Спіни 2-ох електронів можуть бути паралельними (S=1, триплетний стан) або антипаралельними (S = 0, синглетний стан). Питання про те, який з цих двох станів відповідає нормальному рівневі, можна розв'язати на основі спектроскопічних даних.
Розглянемо можливі стани атома Не, що отр. з векторної моделі для всіх електронних конфігурацій з n1=1 і різними значеннями n2, яке ми позначимо просто n. Оскільки в цьому випадку l2=0, то сумарний орбітальний момент атома збігається з моментом другого електрона: L = l2 = l
Для синглетних станів (S=0) повний момент атома = орбітальному, J=L, а для триплетних приймає три значення: J=L±1.
В зв'язку з тим, що синглетні та триплетні стани атома Не не комбінуються між собою, їх приписували колись двом різновидностям Не - парагелію (синглетні стани) та ортогелію (триплетні стани). Хоч ці уявлення про два сорти гелію виявились невірними, терміни «парагелій» та «ортогелій» збереглися.
Крім правила відбору ∆S=0, у спектрі гелію спостерігаються закономірності, що вказують на правила ∆L=±1; ∆J=0,±1
Звернемо увагу на одну дуже важливу обставину. Правила відбору для S, L та J не забороняють таких переходів: 3Р0,1,2 →3S1 Однак у спектрі гелію немає жодної лінії, яка б відповідала переходові атома в найнижчий стан 3S1 з електронною конфігурацією 1s2, існування якого передбачається векторною моделлю. Виглядає так, що атом гелію взагалі не може перебувати в стані 1s23S1, тобто в стані, в якому всі чотири квантові числа двох електронів є однаковими: n1=n2=1, l1=l2=0, ml1=ml2=0, ms1=ms2. Остання рівність випливає з того, що при S=1 спіни обох електронів є паралельними, так що їх проекції на довільний напрям збігаються.
Принцип Паулі у будь-якій системі взаємодіючих частинок у кожному квантовому стані, що характеризується певним набором квантових чисел, може перебувати не більше одного електрона. Оскільки, зокрема, індивідуальні стани електрона в атомі задаються четвіркою, квантових чисел n, l, ml, ms (або n, l, j, mj, принцип Паулі встановлює, що в кожному атомі заданою четвіркою значень вказаних квантових чисел може характеризуватися не більше одного електрона.
6.Магнітні властивості атомів: орбітальний і спіновий магнітний момент. Магнетон Бора. Сумарний магнітний момент електронної оболонки атома. Фактор Ланде.
З
орбітальним рухом електрона в атомі
зв’язаний його механічний момент
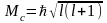 ,
де
,
де
 -
орбітальне квантове число. Поряд з
механічним моментом електрон володіє
і магнітним моментом
-
орбітальне квантове число. Поряд з
механічним моментом електрон володіє
і магнітним моментом
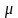 .
Відношення магнітного моменту до
механічного є постійним
.
Відношення магнітного моменту до
механічного є постійним
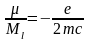 і
наз. гіромагнітним. Тоді
і
наз. гіромагнітним. Тоді
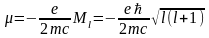 ,
де
,
де
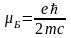 -
магнетон
Бора.
Це були орбітальні моменти електрона,
але досліди (Штерна і Герлаха) показують,
що електрон володіє також власним
механічним
-
магнетон
Бора.
Це були орбітальні моменти електрона,
але досліди (Штерна і Герлаха) показують,
що електрон володіє також власним
механічним
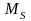 ,
який наз. спіном.
,
який наз. спіном.
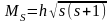 ,де
,де
 -
спінове квантове число. Поряд із власним
механічним моментом електрон володіє
і власним магнітним моментом
-
спінове квантове число. Поряд із власним
механічним моментом електрон володіє
і власним магнітним моментом
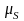 .
Гіромагнітне відношення для власних
(спінових) моментів електрона вдвічі
більше ніж для орбітальних моментів.
.
Гіромагнітне відношення для власних
(спінових) моментів електрона вдвічі
більше ніж для орбітальних моментів.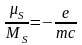 ;
;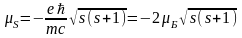 ,
тобто спін володіє подвоєним магнетизмом.
Магнетон Бора виступає в якості природної
одиниці магнітного моменту. Сумарний
магн. момент електронної оболонки атома
є результатом взаємодії спінових і
орбітальних магнітних моментів всіх
електронів. Розрізняють два способи
утв. сумарного магн. моменту: 1) для легких
атомів спін-орбітальна взаємодія не є
сильною, тому між собою сильно взаємодіють
окремо орбітальні моменти
,
тобто спін володіє подвоєним магнетизмом.
Магнетон Бора виступає в якості природної
одиниці магнітного моменту. Сумарний
магн. момент електронної оболонки атома
є результатом взаємодії спінових і
орбітальних магнітних моментів всіх
електронів. Розрізняють два способи
утв. сумарного магн. моменту: 1) для легких
атомів спін-орбітальна взаємодія не є
сильною, тому між собою сильно взаємодіють
окремо орбітальні моменти

(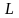 -
результуюче орбітальне квантове число)
і окремо спінові
-
результуюче орбітальне квантове число)
і окремо спінові
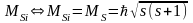 тоді
тоді
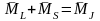 -
сумарний момент ел. оболонки атома
-
сумарний момент ел. оболонки атома
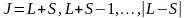 -
результуюче кв. число. Такий зв'язок
наз.
-
результуюче кв. число. Такий зв'язок
наз.
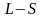 -
зв'язок або зв’язок Рассел-Саундерса.
-
зв'язок або зв’язок Рассел-Саундерса.
2)
починаючи з середини таблиці Мендєлєєва
і далі для важчих атомів спін-орбітальна
взаємодія є істотною. Тобто спочатку
утворюються результуючі моменти кожного
електрона
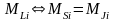 .
Тоді сумарний момент атома
.
Тоді сумарний момент атома
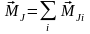 .
Такий зв'язок наз JJ-зв’язком. Знайдемо
сумарний магнітний момент для атома із
-
зв'язком, використовуючи векторну модель
атома. Для квантово-механічного вектора
однозначно можна визначити одну з його
проекцій і його квадрат, тобто вектор
прицесує
навколо напрямку
.
Такий зв'язок наз JJ-зв’язком. Знайдемо
сумарний магнітний момент для атома із
-
зв'язком, використовуючи векторну модель
атома. Для квантово-механічного вектора
однозначно можна визначити одну з його
проекцій і його квадрат, тобто вектор
прицесує
навколо напрямку
 .
.
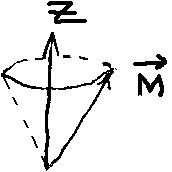 Складання
двох векторів має також особливість,
яка пов’язана з тим, що вони не мають
певного напрямку. По векторним законам
вони утворюють результуючий вектор
,
прицесуючи навколо нього. Зобразимо
векторну модель атома, врахувавши, що
Складання
двох векторів має також особливість,
яка пов’язана з тим, що вони не мають
певного напрямку. По векторним законам
вони утворюють результуючий вектор
,
прицесуючи навколо нього. Зобразимо
векторну модель атома, врахувавши, що
 .
. Вектори
Вектори
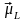 і
і
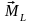 є
протилежними, а вектори
є
протилежними, а вектори
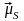 і
і
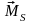 ні
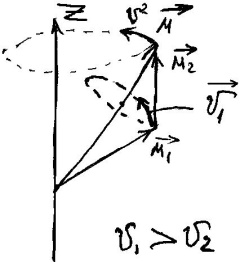
через подвоєний магнетизм спіна. Вектор
ні
через подвоєний магнетизм спіна. Вектор
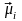 здійснює прицесію і утворює результуюче
середнє значення
здійснює прицесію і утворює результуюче
середнє значення
 ,
яке потрібно визначити.
,
яке потрібно визначити.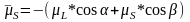 ;
;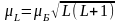 ;
;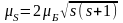 .
.
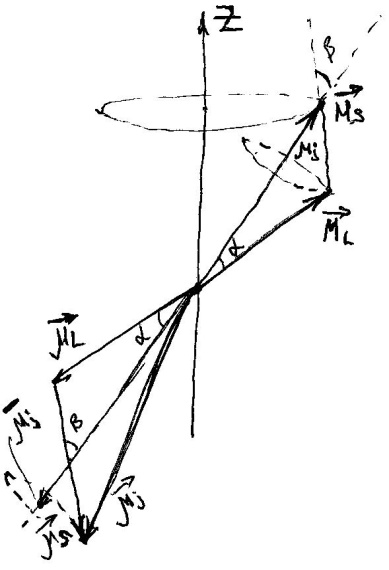
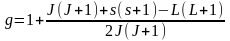 -
множник (фактор) Ланде, який визначає
результуючий магнітний момент атомної
оболонки.
-
множник (фактор) Ланде, який визначає
результуючий магнітний момент атомної
оболонки.
7.Вплив магнітного поля на атоми. Нормальний ефект Зеємана.
В 1896 р. П. Зеєман дослiджував спектри випром. атомів, що перебувають у магн. полi. Bін виявив розщеплення спектральних лiнiй, що було обумовлено взаємодією атомів з магн. полем. Це вiдкриття пiзнiше було названо ефектом 3еемана. Розрiзняють нормальний й аномальний ефекти Зеємана. Якщо спектральна лiнiя розщеплюється на три компоненти, то це нормальнuй ефект Зеємана. Якщо ж число компонентiв розщеплення бiльше, нiж три, то це аномальнuй ефект Зеємана. Звернемо увагу на деякi експер. особливостi прояву нормального ефекту Зеємана. Якщо дослiджується випром., що випускається атомами уздовж магн. поля, то говорять про повздовжнiй ефект Зеемана, якщо ж дослiджується випром., що випускає атомами в площинi, перпендикулярної вектору В, то говорять про поперечнuй ефект Зеемана. Схеми експериментального спостереження поперечного й
повздовжнього ефектiв Зесмана представленi на рис
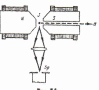 У
випадку нормального поперечного
ефекту
Зеємана
спостер.
три
спектральнi лiнiї,
якi наз.
π- і σ- компонентами. Центральна
π-компонента займає в спектрі те ж
положення, що займала спектральна лінія
при В=0. Симетрично
щодо π-компоненти
розташовані в спектрі по обидві сторони
σ- компоненти. Bci
3
компоненти лiнiйно поляризованi: коливання
вектора Е для
π-компоненти
паралельнi вектору В
магн.поля,
а для σ-компонент
- перпендикулярнi.
У
випадку нормального поперечного
ефекту
Зеємана
спостер.
три
спектральнi лiнiї,
якi наз.
π- і σ- компонентами. Центральна
π-компонента займає в спектрі те ж
положення, що займала спектральна лінія
при В=0. Симетрично
щодо π-компоненти
розташовані в спектрі по обидві сторони
σ- компоненти. Bci
3
компоненти лiнiйно поляризованi: коливання
вектора Е для
π-компоненти
паралельнi вектору В
магн.поля,
а для σ-компонент
- перпендикулярнi.
У випадку повздовжнього нормального ефекту Зеємана π-компоненту не видно, тобто її інтенсивність =0. Видно лише σ-компоненти.
Розщеплення спектральних ліній у магн. полі є наслідком розщеплення енергетичних рівнів. Щоб визначити положення компонентів розщеплення, скористаємося формулою ∆W=-μJ В для добавки до Е за рахунок взаємодії магн. поля із магн. моментом.
μJ=-е/2m
*gJ, де g- фактор Ланде, J=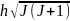 -механічний момент імпульсу електрона.
Тоді ∆W= е/2m *gJ В. ∆W залежить від величини
проекції моменту J на напрямок, заданий
вектором В. Нехай вектор В спрямований
уздовж осі z, тоді ∆W= е/2m *g
-механічний момент імпульсу електрона.
Тоді ∆W= е/2m *gJ В. ∆W залежить від величини
проекції моменту J на напрямок, заданий
вектором В. Нехай вектор В спрямований
уздовж осі z, тоді ∆W= е/2m *g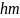 JJ
В
JJ
В
де J- проекція вектора J на виділений напрямок. Врахувавши
μб=
е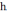 /2m,
отр. ∆W= μб
g
/2m,
отр. ∆W= μб
g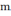 JJВ.
Кожний енергетичний рівень атома
розщеплюється в магн. полі на число
компонентів, рівних числу можливих
орієнтації вектора J. Таким чином, у
магн. полі виродження енергетичного
рівня буде повністю знято.
JJВ.
Кожний енергетичний рівень атома
розщеплюється в магн. полі на число
компонентів, рівних числу можливих
орієнтації вектора J. Таким чином, у
магн. полі виродження енергетичного
рівня буде повністю знято.
8.Експериментальні обгрунтування сучасної теорії атомів: досліди Резерфорда по розсіюванню -частинок.
Одна з перших моделей атома, яка ґрунтувалася на законах класичної фізики, була запропонована в 1904 р. Томсоном. Атом представляє собою нейтральну систему, що складається із позитивно зарядженої кулі (+Ze). Всередині тонкої сфери в деяких рівноважних положеннях знаходяться Z електронів, кожен з яких володіє зарядом –е. Електрони утримуються біля положення рівноваги квазіупружними силами:
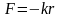
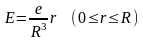 ,
,

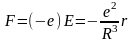
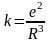
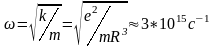
Однак ця модель не могла пояснити спектральних закономірностей: кількість ліній у спектрі не повинна перевищувати число електронів у атомі.
Японський фізик Нагаока запропонував представляти атом за аналогією до сонячної системи. Тобто роль Сонця відіграє позитивно заряджена центральна частина атома, навколо неї по встановленим кільцеподібним орбітам рухаються „планети” – електрони. Через незначні зміщення електрони збурюють електромагнітні хвилі.
В 1903 р. Леонард досліджував проходження електронів через тонку металеву плівку і встановив, що електрони не змінюють свою траєкторію. Це означало, що розміри додатного заряду атома значно менші за 10-8 см.
Дослідження будови атомів були зроблені Резерфордом в 1911 р. Він вивчав розсіювання α-часток при проходженні через тонку золоту фольгу (d=0,1 мкм).

α
мікр.
Pb Po214
Pb-коліматор Аu-фольга
Ядро і α-частки є точковими зарядами.
Розсіювання α-частки здійснюється за рахунок електростатичної взаємодії
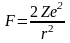 - центральносиметрична сила.
- центральносиметрична сила.
3)  - відсутня енергія віддачі і при взаємодії
ядро залишається нерухомим.
- відсутня енергія віддачі і при взаємодії
ядро залишається нерухомим.
4) 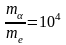 - електрони не впливають на рух α-частки.
- електрони не впливають на рух α-частки.
5) α-частка не підлітає до ядра настільки близько, щоб на неї діяли ядерні сили.
Досліди показали, що при проходженні крізь фольгу більшість α-часток зазнає незначних відхилень. Однак були й такі, що відхилялися на кут більший 150° (1 частка з 8000). Таке значення розсіяння могло трапитися тільки внаслідок дії позитивного заряду атома.
Проходження переважної більшості α-часток крізь фольгу з невеликим розсіюванням свідчило про значні відстані між позитивними зарядами атомів Au, а дуже великі відхилення α-часток – про те, що розміри позитивного заряду атому мають бути набагато меншими за розмір самого атома. Отже, модель Томсона не підтвердилася.
Кутовий розподіл α-часток свідчить про те, що позитивний заряд зосереджений в просторовій області розміром менше 10-12 см. Це стало підставою для планетарної моделі атома Резерфорда, згідно якої атом (розміром ~10-8 см) складається з важкого позитивного заряду (99,98% маси атома) з радіусом менше 10-12 см і негативно заряджених електронів, які постійно обертаються навколо ядра під дією доцентрової кулонівської сили.
Результати досліджень Резерфорда виражаються через поперечний ефективний переріз σ (тобто ймовірність взаємодії в 1 см2) при умові однократної взаємодії (тонка фольга) і відсутності взаємодії між розсіюючими центрами. Кількість часток, які за одиницю часу взаємодіють з ядрами мішені і змінюють траєкторію, визначається:
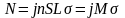
j – густина потоку частинок (число частинок, що потрапляють за одиницю часу на 1 см2 поперечної площі мішені);
n – число частинок мішені на одиницю об’єму (1 см3);
S – опромінювана площа мішені;
L – товщина мішені;
М – повне число розсіюючих центрів в опромінюваній області.
Якщо розглянути розсіювання під кутами θ і φ в тілесний кут dΩ, то число часток, які розсіюються в цей тілесний кут:
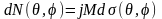
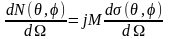
 -
диференційний переріз
-
диференційний переріз
Диференційний переріз пружного розсіяння позитивним зарядом ядра атому Au описується формулою Резерфорда:
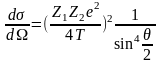
Т – кінетична енергія частинки, що падає на мішень.
9.Борівська теорія атома водню.
