
Билет 34
Анодный процесс окисления металла, который собственно и вызывает его разрушение, обусловлен переходом металла в раствор при его ионизации:
анодный процесс при коррозии металлов -
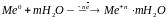 Избыток
электронов с анода перетекает на катод,
где связывается соответствующими
окислителями, в качестве которых чаще
всего выступают ионы водорода или
растворенный в электролите кислород.
Избыток
электронов с анода перетекает на катод,
где связывается соответствующими
окислителями, в качестве которых чаще
всего выступают ионы водорода или
растворенный в электролите кислород.
Если электроны, образующиеся на аноде, связываются на катоде ионами водорода, то говорят о протекании коррозионного процесса с водородной деполяризацией. Такие процессы обычно имеют место при коррозии в кислых средах:
катодный процесс ( водородная деполяризация) -2Н+ + 2е- D Н20
Если электроны, образующиеся на аноде, связываются на катоде растворенными в электролите молекулами кислорода, то говорят о протекании коррозионного процесса с кислородной деполяризацией.
Катодный процесс (кислородная деполяризация) в зависимости от реакции среды может быть представлен следующими схемами:
а) в нейтральных или щелочных средах -
2Н2О + О2 + 4е- D 4ОН-
б) в кислых средах -
О20 + 4Н+ D 2Н2О
Причины электрохимической гетерогенности поверхности металлов разнообразны: ее структурная и химическая неоднородность, структурная неоднородность защитных пленок, неравномерность распределения деформаций в металле вследствие остаточных внутренних напряжений после термической и механической обработки и др. Практически чаще всего в возникновении электрохимической гетерогенности участвует не одни какой-либо фактор, а несколько.
Билет 35
Поляризация вызывается отставанием электродных процессов от процесса передвижения электронов в металле от анода к катоду. Если анодный процесс перехода ионов металла в раствор отстает от перетока электронов от анода к катоду, то это приводит к уменьшению отрицательного заряда на поверхности металла (анодная поляризация). Поляризация тормозит коррозионные процессы, и если бы этот процесс не имел бы места в реальных условиях, многие металлы потеряли бы свое техническое значение.
Любые процессы, уменьшающие явление поляризации, называются процессами деполяризации, а вещества ее вызывающие-деполяризаторами. Деполяризация ускоряет коррозионные процессы.
Наиболее распространена коррозия с кислородной деполяризацией, которая имеет место в нейтральных, щелочных и слабокислых средах. Примером коррозии с кислородной деполяризацией может служить коррозия углеродистой стали в атмосферных условиях. На анодных участках (железо) происходит процесс окисления, при этом железо переходит в виде ионов в раствор:
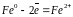
На катодных участках (Fe3C) - восстановление деполяризатора - растворенного кислорода:
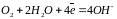 Так протекает реакция ионизации кислорода
в нейтральных или щелочных средах. В
кислых средах кислородная деполяризация
протекает по уравнению:
Так протекает реакция ионизации кислорода
в нейтральных или щелочных средах. В
кислых средах кислородная деполяризация
протекает по уравнению:
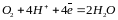
При коррозии имеют место вторичные процессы, при которых ионы железа с ионами гидроксила образуют гидроксид железа (П), который далее окисляется кислородом до гидроксида железа (III):

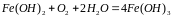
Частично теряя воду, этот гидроксид образует ржавчину переменного состава:
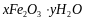
Коррозия с водородной деполяризацией протекает в кислых средах и роль деполяризатора в этом случае выполняют ионы водорода Н+. Например, при коррозии железа в кислых средах на анодных участках происходит окисление железа:
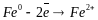
а на катодных - восстановление ионов водорода:
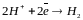
Контролирующим фактором процесса коррозии с водородной деполяризацией обычно является восстановление ионов водорода Н+.. В этом случае большое значение имеет перенапряжение выделения водорода на катоде; чем оно больше, тем медленнее протекает процесс деполяризации, а, значит, и коррозионный процесс в целом.
