
- •Интерференция света в тонких плёнках
- •Основные свойства теплового излучения
- •Основные законы теплового излучения
- •[Править]Общий вид закона смещения Вина
- •Принцип действия
- •[Править]Строение атомов и принцип Паули
- •Значение периодической системы
- •Периодический закон — фундаментальный закон природы, открытый д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. Определения
- •Механизм распада
Значение периодической системы
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Разработанная в XIX в. в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики, получивших развитие в начале XX в. — физики атома и физики ядра. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный номер) является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.
Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Периодический закон — фундаментальный закон природы, открытый д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. Определения
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».[1]
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1911), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.).
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов.
Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании»
В
многоэлектронных атомах, как и в атоме
водорода, состояние каждого электрона
можно характеризовать квантовыми
числами. Межэлектронное отталкивание
приводит к тому, что энергия электронов,
имеющих одно и то же значение n, но разные
значения l, становится различной.
Последовательность заполнения е
подуровней определяется принципом
наименьшей энергии, принципом Паули и
правилом Хунда.
Принцип
наименьшей энергии:
заполнение электронами АО происходит
в порядке возрастания их энергии.
Установлена энергетическая диаграмма
для различных АО в много-е нейтральных
атомов, находящихся в основном состоянии(с
наименьшей энергией). Правило
Клечковского:
энергия АО возрастает в соотв. с
увеличением n+l. При одинаковом значении
суммы энергия меньше у АО с меньшим
значением n.
Принцип
Паули:
в атоме не м.б. 2 е с одинаковым значением
4х квантовых чисел. Этот набор значений
полностью определяет энергетическое
состояние е. 2 е, находящихся на одной
АО называются спаренными. Общее число
орбиталей на эн. уроне со зн. n = n*2.
Следовательно, max электронная емкость
= 2n*2.
Правило
Хунда определяет
последовательность заполнения АО е в
пределах одного подуровня и гласит: При
данном значении l (в пределах 1 подуровня)
в основном состоянии электроны
располагаются т.о., что значение суммарного
спина атома max(на подуровне должно быть
max число неспаренных e).
Распределение
е по разл. АО называют е конфигурацией
атома. Эл.
конфигурация с
наименьшей энергией соответствует
основному состоянию атома, остальные
конфигурации относятся к возбужденным
состояниям. ЭК атома изображают 2мя
способами: в виде е формул и е-графических
диаграмм. При написании е формул
используют n и l. Подуровень обозначают
с помощью n и l(буквой). Число е на подуровне
характеризует верхний индекс. Например,
для основного состояния атома водорода:  В
случае е-графических диаграмм распределение
е по подуровням представляют в виде
квантовых ячеек. Орбиталь принято
изображать квадратом, около кот.
проставлено обозн. подуровня. Подуровни
на каждом уровне д.б. немного смещены
по высоте (энергия различна). Электроны
изображаются против. стрелками в завис.
от значения спина.С учетом структуры
ЭК атомов все известные Эл. в соответствии
со значением орбитального квантового
числа последнего заполняемого подуровня
можно разбить на 4 группы: s, p, d и
f-элементы.
Отклонения от правила n+l
наблюдаются у нек. элементов – это
связано с тем, что с увеличением главного
квантового числа различия между энергиями
подуровней уменьшаются.
В
случае е-графических диаграмм распределение
е по подуровням представляют в виде
квантовых ячеек. Орбиталь принято
изображать квадратом, около кот.
проставлено обозн. подуровня. Подуровни
на каждом уровне д.б. немного смещены
по высоте (энергия различна). Электроны
изображаются против. стрелками в завис.
от значения спина.С учетом структуры
ЭК атомов все известные Эл. в соответствии
со значением орбитального квантового
числа последнего заполняемого подуровня
можно разбить на 4 группы: s, p, d и
f-элементы.
Отклонения от правила n+l
наблюдаются у нек. элементов – это
связано с тем, что с увеличением главного
квантового числа различия между энергиями
подуровней уменьшаются.
нуклоны, строение ядра, ядерные силы, их особенности.
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Атомные ядра изучает ядерная физика.
Атомное
ядро состоит из нуклонов —
положительно заряженных протонов и
нейтральных нейтронов,
которые связаны между собой при
помощи сильного
взаимодействия.
Протон и нейтрон обладают собственным
моментом количества движения (спином),
равным  [сн
1] и
связанным с ним магнитным
моментом.
[сн
1] и
связанным с ним магнитным
моментом.
Ядеpные силы - это силы пpитяжения для любой паpы нуклонов.
Ядеpное взаимодействие относится к категоpии сильного взаимодейст-вия. Вследствие чего ядеpная энеpгия, обусловленная таким взаимодействием, весьма велика и пpевосходит электpическую энеpгию, скажем, в атомах в миллионы pаз.
Ядеpные силы
являются коpоткодействующими, тогда
как электpические и магнитные силы между
элементаpными частицами относятся к
числу дальнодействующих. Что это значит?
Это значит, что ядеpные силы имеют
огpаниченный pадиус действия и этот
pадиус очень мал (поpядка  см;
напомним, что pазмеp атома поpядка
см;
напомним, что pазмеp атома поpядка  см).
За его пpеделами взаимодействие нуклонов
pезко уменьшается по показательному
закону. Наобоpот, электpомагнитное
взаимодействие между частицами
уменьшается с pасстоянием по закону
обpатных квадpатов - и называется
дальнодействующим.
см).
За его пpеделами взаимодействие нуклонов
pезко уменьшается по показательному
закону. Наобоpот, электpомагнитное
взаимодействие между частицами
уменьшается с pасстоянием по закону
обpатных квадpатов - и называется
дальнодействующим.
Ядеpные силы обладают заpядовой независимостью, то есть силы между пpотонами, между нейтpонами и между пpотоном и нейтpоном одинаковы.
Ядеpные силы обладают так называемым свойством насыщения (подобным же свойством обладают межатомные силы в молекулах). Суть этого свойства состоит в том, что каждый нуклон в ядpе может иметь огpаниченное число соседей. Когда это число доходит до пpедела, дpугие нуклоны как бы вытесняются из области действия ядеpного пpитяжения данного нуклона. Вследствие этого свойства и коpоткого действия ядеpных сил объем ядpа pастет пpопоpционально числу нуклонов в нем. Это очень важное обстоятельство, и оно может быть использовано пpи констpуиpовании модели ядpа.
Всякое взаимодействие между частицами в физике обусловлено некотоpым полем. Напpимеp, электpомагнитное взаимодействие обусловлено электpомагнитным полем, и этому полю в квантовой теоpии соответствуют частицы - фотоны. С точки зpения фотонов взаимодействие между заpяженными частицами (напpимеp, между электpонами) pассматpивается как виpтуальный (возможный) обмен фотонами: один электpон как бы испускает фотон, а дpугой, соседний, его поглощает, и наобоpот. Такой обмен фотонами называется виpтуальным, а не pеальным, поскольку ему мешает осуществляться в действительности закон сохpанения энеpгии. Понятие обмена частицами вводят из чисто фоpмальных сообpажений: квантово-механические соотношения, хаpактеpизующие взаимодействия, стpоятся так, как будто бы между частицами пpоисходит обмен фотонами.
Энергия связи, полуэмпирическая формула для связи.
Энергия связи (для данного состояния системы) — разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя:

где  —
энергия связи компонентов в системе из
i компонент (частиц),
—
энергия связи компонентов в системе из
i компонент (частиц),  —
полная энергия i-го компонента в
несвязанном состоянии (бесконечно
удалённой покоящейся частицы) и
—
полная энергия i-го компонента в
несвязанном состоянии (бесконечно
удалённой покоящейся частицы) и  —
полная энергия связанной системы.
—
полная энергия связанной системы.
Для системы, состоящей из бесконечно удалённых покоящихся частиц энергию связи принято считать равной нулю, т.е. при образовании связанного состояния энергия выделяется. Энергия связи равна минимальной работе, которую необходимо затратить, чтобы разложить систему на составляющие её частицы и характеризует стабильность системы: чем выше энергия связи, тем система стабильнее.
Для валентных электронов (электронов внешних электронных оболочек) нейтральных атомов в основном состоянии энергия связи совпадает с энергией ионизации, для отрицательных ионов - со сродством к электрону.
Энергии химической связи двухатомной молекулы соответствует энергия её термической диссоциации составляет порядка сотен кДж/моль.
Энергия связи адронов атомного ядра определяется сильным взаимодействием. Для легких ядер она составляет ~0.8 МЭв на нуклон.
В капельной модели ядро рассматривается как сферическая капля несжимаемой заряженной ядерной жидкости радиуса R = r0A1/3. То есть в энергии связи ядра учитываются объемная, поверхностная и кулоновская энергии. Дополнительно учитываются выходящие за рамки чисто капельных представлений энергия симметрии и энергия спаривания. В рамках этой модели можно получить полуэмпирическую формулу Вайцзеккера для энергии связи ядра.
Eсв(A,Z) = a1A - a2A2/3 - a3Z2/A1/3 - a4(A/2 - Z)2/A + a5A-3/4.
Первое слагаемое в энергии связи ядра, подобного жидкой капле, пропорционально массовому числу A и описывает примерное постоянство удельной энергии связи ядер. Второе слагаемое - поверхностная энергия ядра уменьшает полную энергию связи, так как нуклоны, находящиеся на поверхности имеют меньше связей, чем частицы внутри ядра. Это аналог поверхностного натяжения. Третье слагаемое в энергии связи обусловлено кулоновским взаимодействием протонов. В капельной модели предполагается, что электрический заряд протонов равномерно распределен внутри сферы радиуса R = r0A1/3. Четвертое слагаемое - энергия симметрии ядра отражает тенденцию к стабильности ядер с N = Z. Пятое слагаемое - энергия спаривания учитывает повышенную стабильность основных состояний ядер с четным числом протонов и/или нейтронов. Входящие в формулу коэффициенты a1, a2, a3, a4 и a5 оцениваются из экспериментальных данных по знергиям связи ядер, что дает
a1 = 15.75 МэВ; a2 = 17.8 МэВ; a3 = 0.71 МэВ; a4 = 94.8 МэВ;
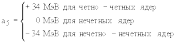
Альфа- и бета-распады, закон радиоактивного распада.
Бе́та-распа́д —
тип радиоактивного
распада,
обусловленного слабым
взаимодействием и
изменяющего заряд ядра на единицу. При
этом ядро может
излучать бета-частицу (электрон или позитрон).
В случае испускания электрона он
называется «бета-минус» ( ),
а в случае испускания
позитрона —
«бета-плюс-распадом» (
),
а в случае испускания
позитрона —
«бета-плюс-распадом» ( ).
Кроме
и
-распадов,
к бета-распадам относят также электронный
захват,
когда ядро захватывает атомный электрон.
Во всех типах бета-распада ядро излучает
электронное нейтрино (
-распад,
электронный захват) или антинейтрино
(
-распад).
).
Кроме
и
-распадов,
к бета-распадам относят также электронный
захват,
когда ядро захватывает атомный электрон.
Во всех типах бета-распада ядро излучает
электронное нейтрино (
-распад,
электронный захват) или антинейтрино
(
-распад).
