
- •Пермский государственный технический университет
- •Пермь 2004
- •Метрология. Основные понятия. (гост 16263-70)
- •Виды измерений.
- •Методы измерений.
- •Технические средства измерений.
- •Датчики физических величин.
- •Классификация датчиков.
- •1. Датчики:
- •Датчик, его метрологические характеристики.
- •Требования к датчикам.
- •Принципы развития датчиков.
- •Резистивные датчики.
- •Существует две схемы включения
- •Тензорезисторы.
- •Конструкция проволочного тензорезистора.
- •Тонкая фольга высокоомного сплава наносится
- •Конструкция пленочного тензорезистора.
- •Погрешности.
- •Градуировка тензодатчиков.
- •Схемы включения тензодатчиков.
- •Датчики давления.
- •Индуктивные датчики
- •4. Погрешность индуктивного датчика
- •Трансформаторные датчики.
- •Индукционные измерительные преобразователи.
- •Пьезоэлектрические преобразователи .
- •Магнитоупругие преобразователи (параметрические ).
- •Цифровые измерительные преобразователи. (ацп)
- •Преобразователи угла с электрической редукцией (редуктосины).
- •Частотные датчики.
- •2. Расходомер со сносом метки.
- •2.Ультразвуковой уровнемер.
- •Емкостные датчики
- •Измерение температуры.
- •Датчики расширения.
- •Терморезисторы .
- •Полупроводниковые терморезисторы.
- •Схемы включения
- •Автоматический уравновешивающий мост (мс-01).
- •Термопары.
- •Конструкции промышленных термопар.
- •Скоростная термопара.
- •Характеристики термопар и погрешности.
- •Автоматический компенсатор ( автоматический потенциометр пс – 01).
- •Пирометры.
- •Радиационные пирометры (рапир).
- •Яркостные пирометры.
- •1) Яркостный пирометр с исчезающей нитью(оппир).
- •2) Яркостный пирометр с оптическим клином.
- •Цветовые пирометры.
- •Измерение давления.
- •А) Жидкостные манометры.
- •Б) Манометры с упругими преобразователями.
- •Измерение уровней (жидкости в резервуаре, сыпучих веществ).
- •Поплавковый датчик уровня с постоянным погружением.
- •Поплавковый датчик уровня переменного погружения (буйковый датчик).
- •Гидростатические уровнемеры
- •Электрические уровнемеры
- •Измерение уровня сыпучести
- •Измерение параметров движения
- •Измерение пути
- •Измерение скорости
- •Тахогенератор постоянного тока
- •Асинхронный тахогенератор
- •Синхронный тахогенератор
- •Частотные датчики скорости
- •П ростейший датчик
- •Фотоэлектрический датчик
- •Индукционный бесконтактный датчик дчв-2500
- •Стробоскопический способ измерения скорости
- •Измерение постоянных ускорений
- •Измерение переменных ускорений (вибраций)
- •Измерение механических усилий.
- •Датчик для измерения линейных моментов.
- •Измерение крутящих моментов
- •Бесконтактный оптический датчик:
- •Фазоимпульсный датчик момента
- •Индуктивный торсиометр
- •Измерение угловых и линейных размеров
- •Реостатный датчик
- •Индуктивный датчик
- •4. Линейная схема включения лвт.
- •5. Сельсин
- •Измерение состава и концентрации вещества по электропроводности.
- •1.Кондуктометрический преобразователь для измерения концентрации соли.
- •2.Потенциалометр – прибор для измерения активности (концентрации) водородных ионов.
- •3.Кулонометрический преобразователь для измерения влажности газов.
- •4.Полярографический преобразователь для исследования состава раствора.
- •Литература по курсу
Измерение состава и концентрации вещества по электропроводности.
1.Кондуктометрический преобразователь для измерения концентрации соли.
И змеряется
электропроводность вещества.
змеряется
электропроводность вещества.
![]() ,
где
,
где
![]()
![]()
Мост с автоматическим уравновешиванием, в одно из плеч включено сопротивление раствора между двумя электродами (Rx), оно зависит от концентрации соли и температуры. Чтобы компенсировать температурную погрешность применяют терморезистор.
Положение движка реохорда определяет концентрацию (мг/л).
R1 и R2 – манганиновые сопротивления
P.S. Солемер для соли Na Cl при t = 200C
мг/л |
5 |
10 |
15 |
20 |
25 |
|
10 |
19.6 |
28.4 |
38 |
46.6 |
2.Потенциалометр – прибор для измерения активности (концентрации) водородных ионов.
Самая чистая вода имеет слабую электропроводность и диссоциируется на ионы водорода Н+ и ионы гидроксила ОН–. диссоциация
Н2О Н+ + ОН–
При равновесии процесса диссоциации (образование ионов) и процесса восстановления (образование из ионов молекул воды) при t = 220С согласно закону действующих масс получим [Н+] . [ОН–] = 10-14. Откуда следует, концентрации СН+= СОН–=10-7. Введем параметр рН = -lg [Н+], где минус в формуле нейтрализует минус логарифмов чисел меньше 1. Чистая вода есть нейтральная среда рН = 7. Кислота PH=0, щелочь PH=14.
При растворении в воде кислоты (кислая среда), концентрация [Н+] , а рН и изменяется от 6 до 0.При растворении щелочей концентрация [Н+] из-за образова-ния молекул воды в процессе восстановления, а рН и изменяется от 8 до 14.
![]()
Р![]()
![]()
![]()
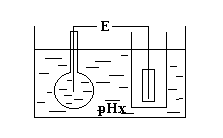 еакция
растворов (кислая, нейтральная, щелочная),
зависящая от числа [Н+], определяется
по разности потенциалов с помощью
потенциалометра. Для определения
показателя рН в раствор помещают два
электрода. Первый электрод – стеклянная
тонкостенная колба с раствором, рН
которого известна, и проводник. Первый
электрод имеет разность потенциалов
еакция
растворов (кислая, нейтральная, щелочная),
зависящая от числа [Н+], определяется
по разности потенциалов с помощью
потенциалометра. Для определения
показателя рН в раствор помещают два
электрода. Первый электрод – стеклянная
тонкостенная колба с раствором, рН
которого известна, и проводник. Первый
электрод имеет разность потенциалов
![]() .
Второй электрод – эталонный (коламельный),
дает постоянную разность потенциалов
.
Второй электрод – эталонный (коламельный),
дает постоянную разность потенциалов
![]() в любом растворе.
в любом растворе.
О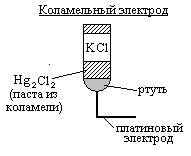 сновной
процесс идет на границе стеклянной
колбы и раствора (рНХ). Натрий из
стекла переходит в раствор, а его место
занимают ионы Н+, при этом возникает
разность потенциалов b
.
pH.
сновной
процесс идет на границе стеклянной
колбы и раствора (рНХ). Натрий из
стекла переходит в раствор, а его место
занимают ионы Н+, при этом возникает
разность потенциалов b
.
pH.
![]() =0,2845+0,058pH.
=0,2845+0,058pH.
![]()
3.Кулонометрический преобразователь для измерения влажности газов.
В нутри
электрода в виде трубки с фосфорным
ангидридом расположены две спирали.
Метод основан на измерении количества
электричества при электролизе воды.
нутри
электрода в виде трубки с фосфорным
ангидридом расположены две спирали.
Метод основан на измерении количества
электричества при электролизе воды.
Когда фосфорный ангидрид сухой – ток отсутствует, между спиралями большое сопротивление. Через трубку прокачивается газ, вода из газа поглощается фосфорным ангидридом. При этом его сопротивление уменьшается, ток между спиралями растет, т.е. чем больше влажность, тем больше ток. Под действием тока вода разлагается на водород и кислород – электролиз.
4.Полярографический преобразователь для исследования состава раствора.
Позволяет определить состав раствора. Через раствор пропускается ток. Под действием тока происходит электролиз (т.е. выделение вещества из раствора), причем разные химические элементы выделяются при разных напряжениях, и, следовательно, токах.
П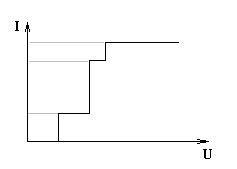 олярограмма
(ВАХ):
олярограмма
(ВАХ):
Т очки
по оси U дают результат
качественного анализа (каждому
химическому элементу соответствует
свой потенциал). Высота по оси I
дает количественный анализ.
очки
по оси U дают результат
качественного анализа (каждому
химическому элементу соответствует
свой потенциал). Высота по оси I
дает количественный анализ.
1 – потенциал первого хим-го элемента,
2
![]() – потенциал второго хим-го элемента,
– потенциал второго хим-го элемента,
3 – потенциал третьего хим-го элемента.
