
- •Шапиро с.В. Основы синергетики
- •Введение
- •Глава первая. Основные определения и постулаты
- •1.1.Три сущности окружающего мира
- •1.2.Что такое материя?
- •1.3. Что такое порядок?
- •1.4. Что такое пространство и время?
- •1.5. Что такое масса и энергия?
- •1.7.Что такое синергия? Взаимосвязь энергетических (материальных) и информационных процессов
- •Глава вторая. Почему возникает порядок?
- •2.1. Почему время необратимо?
- •2.2 Созидательная роль двух тенденций природы
- •2.3. Возникновение простейших упорядоченных состояний
- •Вопросы для самоконтроля
- •Глава третья. Как возникает порядок?
- •3.1. Спонтанное возникновение порядка на молекулярном уровне
- •3.2 Конденсированные системы
- •3.3. Неравновесные системы
- •3.4. Диссипативные системы
- •3.5. Основные законы накопления порядка в диссипативных системах
- •3.6. Неравновесные процессы в химии. Химическая эволюция.
- •3.7.Вселенная, как неравновесная система
- •Вопросы для самоконтроля
- •4.1. Определение и основные признаки управляемых систем
- •4.2. Принцип устройства и действия систем отрицательной обратной связи
- •4.3. Динамика систем обратной связи
- •4.4. Непрерывные (аналоговые) и дискретные (цифровые) способы передачи информации в управляемых системах
- •4.5. Примеры передачи дискретной информации в биологических системах
- •4.6 . Сложные структуры обратной связи. Системы оптимального управления
- •Глава пятая. Информационные процессы в биологических системах
- •5.1. Определение и основные признаки биологических систем
- •5.2. Термодинамика клетки. Возникновение цели.
- •5.4 Самовоспроизводство управляемых систем. Теорема фон Неймана
- •5.5. Структура информационной системы клетки
- •5.6. Информационные процессы в клетке
- •5.7. Сохранение и совершенствование генетической информации
- •5.8. Генная инженерия
- •5.9. Управление в клетке
- •5.10. Управление в многоклеточных организмах
- •5.11. Происхождение и эволюция живых организмов
- •Хордовые
- •5.12. Биосфера.
- •5.13. Формирование нервной системы высших животных
- •5.14. Кибернетика поведения высших животных. Поведенческий инстинкт
- •Глава шестая. Интеллектуальные системы
- •6.1. Определение и основные признаки интеллекта
- •6.2. Познание окружающего мира. Самопознание человеком самого себя
- •6.3. Творчество. Духовная жизнь человека
- •6.4. Мировоззрение
- •6.5. Тезаурус
- •6.6. Труд. Воля
- •6.7. Уровни мышления человека: сознание и подсознание. Связь с другими инстинктами человека
- •6.8. Происхождение и эволюция интеллекта
- •Принципиальная логическая цепочка превращения поведенческого инстинкта в интеллект
- •6.9. Хронология становления человека
- •6.10. Труд животных и человека
- •Которая привела к нервной системе управления
- •6.11.Вера и эстетическое чувство у истоков интеллекта
- •6.12. Приобретённое и врождённое в языке
- •6.13.Искуственный интеллект
- •Модель познания внешнего мира интеллектом
- •Ноосфера
- •7.1. Определение, основные признаки и свойства социальных систем.
- •7.2. Производство
- •7.3. Рынок
- •7.4. Государство
- •7.5. Потребление
- •7.6. Общественный интеллект – естественная основа формирования социальных систем.
- •7.7. Роль интеллекта в расширенном воспроизводстве
- •7.8. Происхождение и эволюция общественного интеллекта и социальных систем
- •7.9. Ноосфера
- •Содержание
- •1.1.Три сущности окружающего мира 5
3.6. Неравновесные процессы в химии. Химическая эволюция.
Наиболее сложные диссипативные системы возникают в результате химических реакций. Иными словами, из всех перечисленных выше неравновесных процессов основной ствол эволюции формируют химические соединения.
Сами по себе
неравновесные процессы в химических
реакциях имеют специфический характер.
Роль источника тепловой энергии играют
вещества, вступающие друг с другом в
экзотермические
реакции
– реакции с выделением тепловой энергии.
Сама тепловая энергия
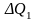 заменяется в них потенциальной энергией
связи электронов с ядрами атомов,
входящих в молекулы исходных реагентов..
В ходе реакций простые вещества
превращаются в более сложные –
происходит накопление отрицательной
энтропии – информации. У них потенциальная
энергия взаимодействия валентных
электронов с атомами меньше. Разность
этих энергий выбрасывается в окружающую
среду в виде тепловой энергии
заменяется в них потенциальной энергией
связи электронов с ядрами атомов,
входящих в молекулы исходных реагентов..
В ходе реакций простые вещества
превращаются в более сложные –
происходит накопление отрицательной
энтропии – информации. У них потенциальная
энергия взаимодействия валентных
электронов с атомами меньше. Разность
этих энергий выбрасывается в окружающую
среду в виде тепловой энергии
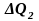 .
Таким образом, окружающая среда служит
холодильником – потребителем теплоты.
Как видим, роль температуры в этих
химических реакциях играет потенциальная
энергия взаимодействия электронов с
ядрами атомов, входящих в молекулы
исходных и конечных веществ химической
реакции.
.
Таким образом, окружающая среда служит
холодильником – потребителем теплоты.
Как видим, роль температуры в этих
химических реакциях играет потенциальная
энергия взаимодействия электронов с
ядрами атомов, входящих в молекулы
исходных и конечных веществ химической
реакции.
Более того, если есть смесь каких- либо веществ с высокими значениями потенциальных энергий, соединения которых обладают меньшей суммарной потенциальной энергией, то вполне естественно возникают химические реакции превращения первых (более простых) во вторые (более сложные).
Примером такого естественного процесса является ржавление железа - соединение кислорода воздуха и железа и образование ржавчины – окисла железа.
Обратный процесс превращение сложных соединений в более простые происходит только под воздействием внешнего потока теплоты. Такие реакции называются эндотермические.
В эндотермических процессах роль источника тепловой энергии играет внешний нагреватель, а роль холодильника – акцептора тепловой энергии – возникающие в процессе реакции простые вещества.
Совокупная реализация эндотермических и экзотермических процессов проводит к задержке во времени (таймированию) неравновесных процессов. Так, например, воздействие солнечных лучей привело в течение многих веков к разложению сложных органических соединений – превращение их в естественные источники тепловой энергии – торф, природный газ, уголь, нефть. Теперь мы их используем в качестве источников тепловой энергии в искусственных (созданных людьми) неравновесных системах. Хотя на самом деле используется тепловая энергия Солнца, запасенная в этих полезных ископаемых.
Как видим, сложные конгломераты веществ, способные в силу конденсированного состояния вступать между собой в экзо- и эндотермические реакции, образуют мощный источник формирования диссипативных систем. При этом эндотермические реакции соединения простых веществ в сложные могут служить «кладовыми» для запасания тепловой энергией, которую они затем могут выделить, вновь разлагаясь на исходные простые. Благодаря этому неравновесные процессы по схеме рисунка 3.3 оказываются распределёнными во времени, причём со сдвигом до нескольких миллионов лет.
Химические реакции образуют в подавляющем большинстве случаев диссипативные системы, в которых проявляются все вышеперечисленные законы [42]. Во-первых, хорошо прослеживается закон системного накопления порядка. Действительно, из атомов образуются простые молекулы или ионные группы: окислы, нитриды, бориды, гидроксильная группа, аммониевая группа, углеводородные группы и т.п. На их основе формируются более сложные молекулы. Например, в [36] описано формирование комплексов краун-эфиров – гетероциклических соединений из простых эфиров (рисунок 3.12).
Д альнейшим
усложнением краун-эфиров является
образование трёхмерных аминоэфиров
– криптандов, сферандов, кавирандов,
криптосферандов, торандов и лигандов.
Другими двумя рядами усложнений молекул
являются:
альнейшим
усложнением краун-эфиров является
образование трёхмерных аминоэфиров
– криптандов, сферандов, кавирандов,
криптосферандов, торандов и лигандов.
Другими двумя рядами усложнений молекул
являются:
1) аминокислоты и полипептидные цепи;2) нуклеотиды и нуклеиновые кислоты. Эти два ряда сформировали вместе ещё более сложный объект природы – биологические системы [69].
Рисунок 3.12.
Краун - эфиры (а) и их комплексы различного состава (б).
Во-вторых, процесс формирования молекулярных структур носит явно выраженный древовидный характер. Действительно, из ста известных химических элементов в природе сформировано около восьми миллионов молекул. Из них только триста тысяч - это так называемые неорганические соединения, т.е. соединения, не содержащие группу СН. Органическая химия сформирована в основном шестью элементами - C, H, O, N, P, S (97,4% - их весовая доля во всех органических элементах). За ними следуют 12 элементов, участвующих в построении физиологически важных биосистем - Na, K, Ca, Mg, Fe, Si, Al, Cl, Cu, Zn, Co (1,6% - их весовая доля во всех живых организмах).
Главное преимущество углерода, как создателя сложных химических структур - в его необычайной химической активности. Он может в равной степени выступать как в роли металла - донора электронов, так и в роли неметалла - их акцептора. И в той, и в другой роли он может быть и одновалентным (т.е. отдавать или принимать 1 электрон), и двух-, и трёх-, и четырёхвалентным. Атомы углерода могут вступать между собой и с другими атомами, как в ковалентные, так и в ионные, и в водородные (Ван-дерваальсовские) связи. Все другие из перечисленных элементов также обладают высокой лабильностью (т.е. химической активностью).
Интересно протекают химические реакции в растворах полипептидов. Как будет сказано в §5.3, одни пептиды катализируют реакции полимеризации (деполимеризации) других полипептидов. Существуют, правда, неактивные полипептиды, ведущие себя нейтрально по отношению к другим полипептидам. Ясно, что в таком растворе непрерывно протекают реакции полимеризации полипептидов. Как показал профессор Московского университета П. Руденко, в таком растворе наблюдается эволюция – постепенно молекулы неактивных полипептидов вытесняются молекулами активных. Следовательно, интенсивность реакций в растворе возрастает.
Процессы управления в химических реакциях осуществляются, как сказано в предыдущем параграфе, катализаторами. В некоторых управляемых химических реакциях возникает циклический процесс – катализатор то включается в инициированную им химическую реакцию, то вновь восстанавливается. Если при этом катализатор имеет цветовую окраску, она периодически меняется.
Классическим примером такой реакции является взаимодействие (в водном растворе) бромноватой и малоновой кислоты под воздействием ионов церия. Эта реакция именуется по имени ее авторов реакцией Белоусова – Жаботинского.[16].
В ходе этой реакции ион церия Се периодически превращается из четырехвалентного Се4+ в трехвалентный Се3+ и наоборот. При этом бромноватая кислота превращается в окисел брома и бромпроизводную малоновой, а также окись углерода и воду.
Внешне она выглядит так. В стакане находится голубая жидкость. Экспериментатор капает в стакан из пипетки несколько капель бесцветной жидкости. Раствор в стакане становится розовым. Через минуту он становится снова голубым, потом опять розовым и так несколько раз.
В[6] показано, как в результате волновых химических процессов образуются спиральные волны – химические ревербераторы.
Возникновение химических ревербераторов свидетельствует ещё об одной особенности циклических реакций – объём вовлечённых в эти реакции веществ должен обязательно увеличиваться для того, чтобы они поддерживались неограниченно долгое время.
Таким образом, из всего многообразия диссипативных процессов локального накопления порядка именно химические создают наиболее высокую плотность информации и формируют основной ствол развития природы.
