
- •Строение сплавов.
- •Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии( диаграмма состояния III рода).
- •Диаграмма состояния сплавов, образующих химическое соединение (диаграмма состояния IV рода).
- •2.3. Зависимость свойств сплавов от типа диаграммы состояния
ОСНОВЫ ТЕОРИИ СПЛАВОВ
Металлические сплавы
Применение чистых металлов в промышленности крайне ограничено. Их использование не всегда экономически выгодно, часто они не отвечают требуемым свойствам. В металлах не всегда сочетаются одновременно несколько необходимых свойств. Их прочность невысока, электрические свойства зависят от изменения температуры, они имеют высокий коэффициент теплового расширения и т.д. Сплавы в отличие от чистых металлов можно получить почти с любыми заданными свойствами.
Основные понятия. Правило фаз.
Сплавом называется макроскопически однородная система, состоящая из двух и более химических элементов.
Сплавом называется материал, полученный сплавлением двух или более веществ.
Вещества, которые образуют сплав, называются компонентами.
Компонент, количественно преобладающий в сплаве, называется основным. Сплавы часто называют по основному компоненту: медные, алюминиевые, магниевые и т. д. По числу компонентов различают двухкомпонентные (двойные), трехкомпонентные (тройные), четырехкомпонентные и многокомпонентные сплавы.
Мы будем рассматривать строение и свойства двухкомпонентных сплавов, так как они является основой для изучения сплавов, состоящих из большего числа компонентов. Кроме того, основу большинства многокомпонентных сплавов чаще всего составляет двухкомпонентный сплав.
Компонентами сплава могут быть металлы (железо, медь, алюминий, никель и т. д.) и неметаллические элементы (углерод). Компонентом могут быть и химические соединения, если в рассматриваемых интервалах температур они не диссоциируют на свои составные части. Количество компонентов, составляющих систему (сплав), может быть различным.
Чистый металл — это однокомпонентная система; сплав двух металлов — двухкомпонентная, и т. д.
Выбор базового компонента сплава определяется техническим заданием на его свойства. В зависимости от базового компонента все сплавы делятся на:
черные, основу которых составляет железо (стали, чугуны) — и
цветные, основу которых составляет любой металл, кроме железа (алюминиевые, медные, никелевые, титановые и др.).
Выбор других компонентов сплава производится на основе оценки взаимодействия элементов периодической системы с базовым компонентом и между собой. Их взаимодействие учитывается и в жидком, и в твердом состояниях, так как сплавление проводится при температурах, превышающих температуру плавления базового компонента, а затем сплав, охлаждаясь, кристаллизуется и остывает до температуры окружающей среды. При этом изменяется не только агрегатное состояние системы, но и ее фазовый состав в зависимости от температуры и скорости охлаждения.
Металлический сплав получают сплавлением металлов или преимущественно металлов с неметаллами. При этом металлический сплав обладает комплексом характерных металлических свойств.
Фазой называют однородную часть сплава, характеризующуюся определенным составом и строением и отделенную от других частей сплава поверхностью раздела при переходе через которую состав или строение вещества изменяется скачкообразно.
Фазы металлических сплавов
В сплавах компоненты могут вступать во взаимодействие с образованием различных фаз.
Различают следующие фазы металлических сплавов:
жидкие растворы;
твердые растворы;
химические соединения.
Раствором называется твердая или жидкая гомогенная (однородная) система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Жидкие растворы. Большинство металлов растворяются друг в друге в жидком состоянии неограниченно (в любых соотношениях). При этом образуется однородный жидкий раствор, в котором атомы растворимого металла равномерно распределены среди атомов металла-растворителя.
Твердые растворы. В твердом растворе металл-растворитель сохраняет свою кристаллическую решетку, а растворимый элемент (металл или неметалл) распределяется в ней в виде отдельных атомов. Твердые растворы бывают двух типов:
твердые растворы замещения — и
В твердых растворах замещения (рис. 5, а) часть атомов кристаллической решетки металла-растворителя замещена атомами другого компонента. Атомы растворенного компонента могут замещать атомы растворителя в любых узлах решетки. Поэтому твердые растворы замещения называют неупорядоченными твердыми растворами.
В твердых растворах внедрения (рис. 5, б) атомы растворенного компонента внедряются в межатомное пространство кристаллической решетки компонента-растворителя. При этом атомы располагаются в таких пустотах, где для них имеется больше свободного пространства.

Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
При образовании твердого раствора кристаллическая решетка всегда искажается, так как атомы растворителя и растворенного компонента различны.
Строение сплавов.
По строению в твердом состоянии все сплавы подразделяются на три основных типа:
механические смеси,
химические соединения
твердые растворы.
Механическая смесь двух компонентов А и В образуется, если они не способны к взаимодействию или взаимному растворению. Каждый компонент при этом кристаллизуется в свою кристаллическую решетку. Структура таких механических смесей неоднородна, состоит из отдельных зерен компонента А и компонента В. Свойства механических смесей зависят от количественного соотношения компонентов: чем больше в сплаве данного компонента, тем ближе к его свойствам свойства смеси. Обычно механические смеси образуют металлы, заметно отличающиеся друг от друга по атомному объему и по температуре плавления. Механические смеси не обязательно состоят из чистых компонентов. Образовывать механические смеси могут также твердые растворы и химические соединения.
Химическое соединение образуется, когда компоненты сплава А и В вступают в химическое взаимодействие. При этом соотношение чисел атомов в соединении соответствует его химической формуле А т Вп. Химическое соединение имеет свою кристаллическую решетку, которая отличается от кристаллических решеток компонентов. Химические соединения имеют однородную структуру, состоящую из одинаковых по составу и свойствам зерен.
Свойства химического соединения резко отличаются от свойств образующих его компонентов. Обычно они являются очень твердыми и хрупкими веществами. Часто химические соединения рассматривают как самостоятельные компоненты, образующие сплавы с исходными компонентами, составляющими соединение.
Химические соединения и родственные им фазы постоянного состава в металлических сплавах многообразны.
Они имеют характерные особенности, отличающие их от твердых растворов:
их кристаллическая решетка отличается от кристаллических решеток компонентов, образующих соединение;
соотношение элементов в них кратно целым числам;
их свойства отличны от свойств образующих элементов;
они плавятся при постоянной температуре;
их образование сопровождается значительным тепловым эффектом.
Под структурой понимают форму, размер и характер взаимного расположения фаз в сплавах.
Структурными составляющими называют обособленные части сплава, имеющие одинаковое строение с присущими им характерными особенностями.
Структурными составляющими могут быть как фазы, так и смеси фаз.
Закономерности существования фаз в сплаве в условиях равновесия определяются правилом фаз (законом Гиббса).
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз.
Числом степеней свободы (вариантностью) сплава называют число внешних и внутренних факторов (температура, давление и концентрация), которое можно изменять без изменения числа фаз в сплаве.
Когда число степеней свободы равно нулю, нельзя изменять внутренние и внешние факторы без изменения числа фаз. Такое состояние называют нонвариантным.
Если число степеней свободы равно единице, то один из внутренних и внешних факторов может изменятся в определенных пределах и это не вызовет изменения числа фаз. Такое состояние называется моновариантным.
Правило фаз выражается следующим уравнением:
С = К + В - Ф,
где С — число степеней свободы; К — число компонентов; В — число внешних переменных факторов (температура, давление); Ф — число фаз.
Если учесть, что все превращения в металлических сплавах происходят при постоянном давлении, то число внешних переменных факторов В=1 (температура) и правило фаз принимает вид:
С = К+1-Ф.
Пользуясь правилом фаз, рассмотрим охлаждение чистого металла. В этом случае число компонентов К=1.
Если металл находится в жидком состоянии, число фаз Ф=1. Тогда число степеней свободы С=1+1-1=1 (моновариантное состояние).
Температуру можно изменять, не изменяя числа фаз.
В процессе кристаллизации одновременно существуют две фазы — жидкая и твердая, Ф-2.
Тогда число степеней свободы С-1+1-2=0 (нонвариантное состояние).
Температура не может изменяться, пока не пропадет одна из фаз.
Как только кристаллизация завершится, остается одна твердая фаза, Ф=1, число степеней свободы С=1+1-1=1 и температура вновь может изменяться.
Для двухкомпонентного сплава К=2 правило фаз принимает вид
С=2+1-Ф=3-Ф.
Отсюда следует, что в двойных сплавах число одновременно существующих фаз не может быть больше трех, так как число степеней свободы не может быть отрицательным.
Диаграммы состояния сплавов
Для определения количества фаз в сплаве, их состава пользуются диаграммами фазового равновесия — диаграммами состояния.
Диаграмма состояния — графическое изображение фазового состава сплава в состоянии равновесия или близком к нему в зависимости от содержания компонентов в сплаве и от температуры.
Она строится экспериментально по кривым охлаждения сплавов.
В отличие от чистых металлов сплавы кристаллизуются не при постоянной температуре, а в интервале температур. Поэтому на кривых охлаждения сплавов имеется две критические точки. Критическими точками называются температуры начала и конца фазовых превращений.

Рис. 2.1. Кривые охлаждения сплавов:
а — механической смеси, б — твердого раствора
Диаграмму состояния строят в координатах температура — концентрация. Линии диаграммы разграничивают области одинаковых фазовых состояний.
Вид диаграммы зависит от того, как взаимодействуют между собой компоненты.
Для построения диаграммы состояния используют большое количество кривых охлаждения для сплавов различных концентраций. При построении диаграммы критические точки переносятся с кривых охлаждения на диаграмму и соединяются линией.
В получившихся на диаграмме областях записывают фазы или структурные составляющие.
Линия диаграммы состояния на которой при охлаждении начинается кристаллизация сплава, называется линией ликвидус, а линия, на которой кристаллизация завершается, — линией солидус.
Диаграмма состояния сплавив, образующих механические смеси (диаграмма состояния I рода).
Компоненты таких сплавов в жидком состоянии неограниченно растворимы друг в друге, а в твердом — нерастворимы и не образуют химических соединений. Поэтому в этом сплаве возможно образование трех фаз: жидкого сплава и кристаллов компонентов.
Механические смеси образуют сплавы свинца и сурьмы, свинца и олова, цинка и олова, алюминия и кремния и др.
Рассмотрим построение диаграммы на примере сплава свинца с сурьмой. Вначале строятся кривые охлаждения чистых свинца и сурьмы.
Температуры их кристаллизации соответствуют горизонтальным площадкам на кривых / и 6 (для свинца 327 °С и для сурьмы 631 °С). Далее рассматриваются несколько сплавов с соответствующим содержанием свинца РЬ и сурьмы SЬ, %,
например: РЬ 95, SЬ 5; РЬ 90, SЬ 10; РЬ 87, SЬ 13; РЬ 60, SЬ 40. Строятся кривые их охлаждения (кривые 2-5 соответственно).

Рис.2.2. Диаграмма состояния сплавов РЬ - SЬ
Кристаллизация первого сплава (5 % SЬ) происходит следующим образом:
приблизительно до 300 °С он остается жидким,
а начиная с 300 "С скорость охлаждения замедляется, при этом начинается кристаллизация свинца;
оставшаяся часть жидкого сплава обедняется свинцом, следовательно, обогащается сурьмой.
Когда содержание сурьмы составит 13 % , произойдет кристаллизация эвтектики при температуре 246 °С ( горизонтальный участок кривой 2). Эвтектикой называют равномерную мелкодисперсную механическую смесь двух фаз, которые одновременно кристаллизуются из жидкого сплава.
В данном случае эвтектика состоит из кристаллов свинца и сурьмы. Эвтектика имеет определенный химический состав (в данном случае 13 % 5Ь и 87 % РЬ) и образуется при постоянной температуре (в данном случае 246 °С).
Следующий сплав (10 % 5Ь) кристаллизуется аналогично первому, но температура начала кристаллизации у него ниже, а температура конца кристаллизации та же — 246 °С, когда содержание сурьмы в жидком сплаве составит 13 % (кривая 3). Третий сплав (кривая 4), содержащий 13 % SЬ и 87 % РЬ, остается жидким до 246 °С, а затем кристаллизация происходит при этой температуре с образованием эвтектики. Этот сплав кристаллизуется при постоянной температуре, самой низкой для данной системы, состоит только из эвтектики и называется эвтектическим. Кристаллизация четвертого сплава (40 % ЗЬ) начинается при температуре около 400 °С с выделением избыточных кристаллов сурьмы. Жидкий сплав обедняется сурьмой и при содержании в нем 13 % сурьмы и температуре 246 °С происходит образование эвтектики и кристаллизация завершается.
Критические точки, полученные на кривых охлаждения, переносятся на диаграмму состояния и соединяются. Получаются линии АЕВ и МЕN. Линия ЛЕВ диаграммы является линией ликвидус: все сплавы, лежащие выше этой линии, находятся в жидком состоянии. Линия МЕN является линией солидус, ниже нее все сплавы свинец – сурьма находятся в твердом состоянии. В интервале между ликвидусом и солидусом сплав состоит из двух фаз — жидкого раствора и кристаллов одного из компонентов. Сплавы, содержащие менее 13 % ЗЪ, лежащие слева от эвтектического сплава, называют доэвтектическими, а более 13 % 5Ь, — заэвтектическими. Структура и свойства*•-
их резко отличаются. В доэвтектических сплавах наряду с эвтектикой находятся избыточные кристаллы свинца (рис. 2.3, а), а в заэвтектических — кристаллы сурьмы (рис. 2.3, в). Различие структур определяет различие свойств сплавов.

Рис 2.3. Структуры сплавов РЪ-5Ъ:
а — доэвтектического, б — эвтектического,
в — заэвтектического
Чтобы определить состояние сплава любого состава при данной температуре и для нахождения его критических точек с помощью диаграммы, нужно из точки, указывающей содержание концентрации данного сплава, провести вертикальную линию до пересечения с линиями ликвидус и солидус (см. рис. 2.2). Точки пересечения показывают начало и конец кристаллизации заданного сплава. Например, требуется определить состояние сплава, содержащего 50 % сурьмы при температуре 400 °С. Точка пересечения вертикали с линиями ликвидус и солидус показывают, что данный сплав будет иметь две фазы — жидкий сплав и кристаллы сурьмы, так как точка соответствующая 400 "С лежит в области диаграммы ВЕЫ.
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (диаграмма состояния II рода). Эти диаграммы соответ-
ствуют сплавам, у которых компоненты и в жидком, и в твердом состоянии образуют раствор. Для таких сплавов возможно образование двух фаз: жидкого сплава и твердого раствора. К таким сплавам относят медь - никель, железо - никель, железо - хром, кобальт - хром и др. Диаграммы их состояния строят так же, как диаграммы 1-го рода, на основании анализа кривых охлаждении сплавов с различным содержанием составляющих их компонентов. Рассмотрим диаграмму состояния сплавов медь - никель (рис. 2.4). Кривая 1 является кривой охлаждения чистой меди с температурой кристаллизации 1083 °С, кривая 5 — кривая охлаждения никеля с температурой кристаллизации 1452 °С. Кривая 2 характерна для кристаллизации сплава, содержащего 20 % никеля. Кристаллизация этого сплава начинается в точке а, при этом образуется кристаллическая решетка меди, в которой имеется 20 % никеля. В точке Ь кристаллизация заканчивается. Аналогично кристаллизуются сплавы с содержанием 40 % (кривая 3) и 80 % никеля (кривая 4), но точки начала (а} и а2) и конца (Ь1 и Ь2) кристаллизации у первого сплава ниже, чем у второго. Все точки начала и конца кристаллизации меди, никеля и указанных выше сплавов переносятся на диаграмму (рис. 2.4, справа). Соединяя эти точки, получим линии ликвидус АаВ и солидус АЬВ. Выше линии АаВ сплав меди с никелем находится в жидком стоянии, а ниже линии АЬВ — в твердом. В зоне между линиями АаВ и АЬВ имеются две фазы: жидкий сплав и кристаллы твердого раствора никеля и меди.
Диаграмма П-го рода отличается от диаграммы 1-го рода тем, что в первом случае образуется одна кристаллическая решетка, а значит, нет и эвтектического сплава как у сплавов, образующих механическую смесь. Кроме того, у сплавов медь — никель начало и конец кристаллизаци-
сплавов с различным содержанием компонентов протекают при различных температурах.

Рис.2.4. Диаграмма состояния сплавов Си - М
Правило отрезков. В процессе кристаллизации непрерывно изменяется концентрация фаз и количество каждой фазы (количество жидкой фазы уменьшается, а твердой увеличивается). Концентрацию (состав) и количество каждой фазы можно определить в любой точке двухфазной области диаграммы состояния, используя правило отрезков. Рассмотрим применение правила отрезков на примере изученных выше диаграмм состояния (рис. 2.5). Правило отрезков формулируется следующим образом. Через заданную точку диаграммы состояния проводится горизонтальная линия до пересечения с линиями, ограничивающими данную область диаграммы. Проекции точек пересечения на ось концентраций показывают состав фаз. Длины отрезков горизонтальной линии между заданной точкой и точками, определяющими состав фаз, обратно пропорциональны количествам этих фаз.
На рис. 2.5 показано применение правила отрезков для точки т диаграммы. Через нее проведена горизонтальная линия и отмечены точки пересечения с линиями диаграммы 1с и п. Проекции этих точек на ось концентраций к! и п! показывают состав фаз. Так, для диаграммы состояния свинец - сурьма (рис.2.5,а) точка к! показывает состав жидкой фазы, а точка п! твердой фазы (100 % 5Ь). Для диаграммы состояния медь - никель (рис.2.5,б) точка к! показывает состав жидкой фазы, а точка п! состав твердого раствора.

Рис. 2.5. Пример применения правила отрезков: а — для сплавов, образующих механические смеси, б — для сплавов, образующих твердые растворы
Рассмотрим теперь определение относительного количества каждой фазы. Обозначим количество жидкой фазы Ож, а количество твердой фазы — О^. (Для примера на рис. 2.5,а твердой фазой является сурьма, а на рис. 2.5,6 — твердый раствор). Тогда, в соответствии с правилом отрезков, количества фаз обратно пропорциональны длинам соответствующих отрезков:
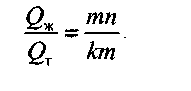
Если обозначить количество всего сплава (), то ему будет соответствовать отрезок 1ш, и можно найти относительные количества фаз:

Правило отрезков может быть применено для любой двухфазной области диаграммы состояния, т.е. не только для рассмотрения кристаллизации сплава, но и для изучения процессов, происходящих в твердом состоянии. В однофазных областях диаграммы состояния правило отрезков неприменимо. Любая точка внутри однофазной области характеризует концентрацию данной фазы.
