
- •Лидин р.А. Химия. Полный справочник для подготовки к егэ
- •Содержание
- •Предисловие
- •1. Распространенные элементы. Строение атомов. Электронные оболочки. Орбитали
- •Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
- •В каждой орбитали может разместиться не более двух электронов.
- •В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
- •Примеры заданий части а
- •4) Фосфор
- •2. Периодический закон. Периодическая система. Электроотрицательность. Степени окисления
- •Свойства элементов находятся в периодической зависимости от порядкового номера.
- •Примеры заданий частей а, в
- •3. Молекулы. Химическая связь. Строение веществ
- •Примеры заданий части а
- •4. Классификация и взаимосвязь неорганических веществ
- •Примеры заданий частей а, в, с
- •4) Хром
- •5. Металлы главных подгрупп I–III групп
- •5.1. Натрий
- •5.2. Калий
- •5.3. Кальций
- •5.4. Жёсткость воды
- •5.5. Алюминий
- •Примеры заданий части а
- •2) Кальций
- •6. Переходные металлы 4‑го периода. Свойства, способы получения. Общие свойства металлов
- •6.1. Хром
- •6.2. Марганец
- •6.3. Железо
- •Доменный процесс производства чугуна
- •Производство стали
- •6.4. Общие свойства металлов. Коррозия
- •Примеры заданий части a
- •4) Железо
- •7. Неметаллы главных подгрупп IV–VII групп
- •7.1. Водород
- •7.2. Галогены
- •7.2.1. Хлор. Хлороводород
- •7.2.2. Хлориды
- •7.2.3. Гипохлориты. Хлораты
- •7.2.4. Бромиды. Иодиды
- •7.3. Халькогены
- •7.3.1. Кислород
- •7.3.2. Сера. Сероводород. Сульфиды
- •7.3.3. Диоксид серы. Сульфиты
- •7.3.4. Серная кислота. Сульфаты
- •7.4. Неметаллы va‑группы
- •7.4.1. Азот. Аммиак
- •7.4.2. Оксиды азота. Азотная кислота
- •7.4.3. Нитриты. Нитраты
- •7.4.4. Фосфор
- •7.5. Неметаллы iva‑группы
- •7.5.1. Углерод в свободном виде
- •7.5.2. Оксиды углерода
- •7.5.3. Карбонаты
- •7.5.4. Кремний
- •Примеры заданий части а
- •1) Водород
- •8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
- •Примеры заданий частей а, в
- •9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
- •9.1. Алканы. Циклоалканы
- •3), Формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
- •9.2. Алкены. Алкадиены
- •9.3. Алкины
- •9.4. Арены
- •Примеры заданий частей а, в
- •4. Алкины
- •6. Арены
- •10. Кислородсодержащие органические соединения
- •10.1. Спирты. Простые эфиры. Фенолы
- •10.2. Альдегиды и кетоны
- •10.3. Карбоновые кислоты. Сложные эфиры. Жиры
- •10.4. Углеводы
- •Примеры заданий частей а, в
- •1) Кислород
- •11. Азотсодержащие органические соединения
- •11.1. Нитросоединения. Амины
- •11.2. Аминокислоты. Белки
- •Примеры заданий частей а, в, с
- •12. Химические реакции. Скорость, энергетика и обратимость
- •12.1. Скорость реакций
- •Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов
- •12.2. Энергетика реакций
- •12.3. Обратимость реакций
- •При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.
- •Примеры заданий части а
- •13. Водные растворы. Растворимость и диссоциация веществ. Ионный обмен. Гидролиз солей
- •13.1. Растворимость веществ в воде
- •13.2. Электролитическая диссоциация
- •13.3. Диссоциация воды. Среда растворов
- •13.4. Реакции ионного обмена
- •13.5. Гидролиз солей
- •Примеры заданий частей а, в
- •14. Окислительно‑восстановительные реакции. Электролиз
- •14.1. Окислители и восстановители
- •14.2. Подбор коэффициентов методом электронного баланса
- •14.3. Ряд напряжений металлов
- •14.4. Электролиз расплава и раствора
- •Примеры заданий частей а, в, с
- •15. Решение расчетных задач
- •15.1. Массовая доля растворенного вещества. Разбавление, концентрирование и смешивание растворов
- •Примеры решения задач
- •Задания для самостоятельного решения части в
- •15.2. Объемное отношение газов
- •Пример решения задачи
- •Задания для самостоятельного решения части а
- •15.3. Масса вещества (объем газа) по известному количеству другого реагента (продукта) Примеры решения задачи
- •Задания для самостоятельного решения части в
- •15.4. Тепловой эффект реакции Пример решения задачи части в
- •Задания для самостоятельного решения части а
- •15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
- •Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе Пример решения задачи
- •Задания для самостоятельного решения частей в, с
- •15.7. Нахождение молекулярной формулы органического соединения
- •Примеры решения задач
- •Задания для самостоятельного решения части с
- •Раздел 15
15.4. Тепловой эффект реакции Пример решения задачи части в
Вычислите тепловой эффект (кДж) реакции полной нейтрализации гидроксида натрия серной кислотой, если в расчете на 10 г щелочи выделяется 16,25 кДж теплоты.
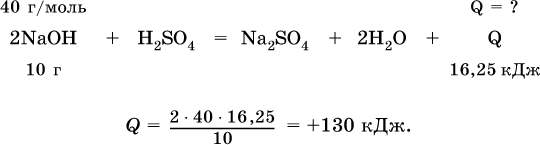
Задания для самостоятельного решения части а
1. В реакции между железом и хлором на 11,2 л (н.у.) окислителя приходится выделение 132 кДж теплоты, следовательно, в расчете на 0,5 моль железа выделится количество теплоты (кДж), равное
1) +198
2) +148,5
3) +99
4) +49,5
2. Триоксид серы массой 280 г вносят в воду, протекает реакция с тепловым эффектом +73 кДж. Количество теплоты (кДж) в условиях опыта равно
1) +204,4
2) +255,5
3) +408,8
4) +511
3. Термическое разложение нитрата калия привело к выделению 4,48 л (н.у.) газа. Тепловой эффект реакции равен ‑282 кДж, следовательно, сопровождающее процесс количество теплоты (кДж) составляет
1) ‑56,4
2) ‑112,8
3) ‑225,6
4) ‑282
4. Сожжено 10 л (н.у.) аммиака на воздухе (тепловой эффект реакции +1532 кДж). По условию опыта количество теплоты составит
1) +171
2) +342
3) +766
4) +855
5. Термическое разложение карбоната кальция с тепловым эффектом ‑179 кДж привело к получению 33,6 г твердого остатка. В этих условиях поглощенное количество теплоты (кДж) равно
1) ‑537
2) ‑214,8
3) ‑375,9
4) ‑107,4
6. При термическом разложении дихромата аммония протекает экзотермическая реакция, в которой на 1,4 моль образовавшейся воды приходится +106 кДж; следовательно тепловой эффект реакции (кДж) равен:
1) +505
2) +404
3) +303
4) +606
7. Реакция сгорания угарного газа в кислороде сопровождается экзо‑эффектом +566 кДж. Количество теплоты (кДж), приходящееся на 224 г угарного газа, равно
1) +1132
2) +2264
3) +283
4) +566
8. Тепловой эффект реакции полного сгорания ацетилена в кислороде равен +2596 кДж. При сгорании 2 л (н.у.) этого газа выделяется количество теплоты (кДж)
1) +29
2) +58
3) +116
4) +232
9. В термическом разложении метана с образованием ацетилена и 560 л (н.у.) водорода тепловой эффект реакции равен ‑376 кДж. Количество поглощенной теплоты (кДж) в условиях опыта составляет
1) ‑2256
2) ‑752
3) ‑1128
4) ‑376
10. При полном сгорании бутадиена‑1,3 в кислороде на 0,5 моль затраченного окислителя выделяется +18 кДж теплоты, следовательно, на 0,5 моль вступившего в реакцию алкадиена приходится количество теплоты (кДж), равное
1) +49,5
2) +99
3) +148,5
4) +198
15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
Избыток и недостаток реагентов. Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т. е. в соответствии с уравнениями реакции. Чаще один из реагентов берется в избытке, а следовательно, другой реагент оказывается в недостатке. Избыток реагента участвовать в реакции не будет.
Для реакции aA + bB = cC + dD определение реагентов, взятых в избыткеи в недостатке, проводят по неравенству (А – в недостатке, В – в избытке):
![]()
где n(общ. В) – общее (взятое с избытком) количество реагента В, пB – стехиометрическое (необходимое для реакции) количество В, n(изб. В) – избыточное количество В, причем
n(изб. B) = n(общ. B) – nB.
Внимание! Расчет получаемых количеств (масс, объемов) продуктов проводят по реагенту в недостатке.
Степень чистоты вещества. Химические вещества никогда не бывают идеально чистыми, они всегда содержат в себе примеси.
Массовая доля вещества В в смеси, например А + В + С, – это отношение массы вещества В к массе смеси:
![]()
Сумма массовых долей всех веществ смеси равна 1 (100 %).
Если в смеси примесь присутствует в следовом (неопределяемом) количестве, то говорят о практически чистом веществе. Когда же в веществе имеется примесь в заметном (определяемом) количестве, то само вещество называют основным (его количество преобладает), а другое вещество – это и есть примесь.
Степень чистоты основного вещества В – это массовая доля этого вещества в навеске с определенной массой:
![]()
Природные вещества (минералы, руды) всегда содержат заметное количество примеси (примесей).
