
Лекция 12 Основы процессов получения материалов высокой чистоты и материалов со специальными свойствами
Процессы испарения из жидких сплавов. Дистилляция и ректификация. Закономерности образования новой фазы из расплавов. Аморфные металлические материалы. Ликвационные и кристаллизационные методы рафинирования.
В последние десятилетия в сильной степени возросло значение особо чистых металлов, их сплавов и полупроводниковых материалов. Сверхчистые металлы и полупроводниковые материалы необходимы для атомной энергетики, ракетно-космической техники, радиоэлектроники, а также для ряда других областей.
Аморфные металлы и сплавы могут обладать, по сравнению кристаллическими материалами, специфическим сочетанием физико-химических свойств, которое позволяет использовать эти материалы при изготовлении современных изделий различного назначения.
Процессы испарения из жидких сплавов (растворов).
В этих процессах для разделения компонентов используется способность веществ переходить в газовую фазу.
Испарение - процесс превращения жидкости или твердого тела в газообразное состояние или в пар.
Конденсация – противоположный испарению процесс, переход из газообразного в твердое или жидкое состояние.
Перегонкой называют испарение вещества с последующей конденсацией образовавшихся паров и отделением конденсата.
Дистилляция - это метод разделения компонентов однократный испарением жидкости и последующей конденсацией обогащенного пара.
Сублимация (возгонка) - переход вещества из твердой фазы в газообразную (минуя жидкость). На этом методе основывается разделение компонентов из твердого сплава (вещества) путем испарения компонентов из твердой фазы с последующей конденсацией обогащенного пара.
Ректификация - способ разделения жидких смесей, состоящих из нескольких компонентов, основывается на многократном испарении жидкости с последующей конденсацией компонента. Ректификация используются для получения Zn, Cd, Hg щелочных металлов и др.
Возможен также переход из газообразного состояния в плазменное.
На явлениях испарения, возгонки и конденсации основаны также следующие распространенные технологические процессы:
-фракционная разгонка, предусматривающая испарение из жидкой фазы, фракционный отбор и конденсацию;
-процессы хлорирующего обжига и разделения галогенидов и оксихлоридов (Ti, Zr -цирконий, V, Mo, Si и др.).
-транспортные реакции (Ti, Zr -цирконий, Nb, Be, Al и др.). Сущность химических транспортных реакций заключается в том, что твердое или жидкое вещество А, взаимодействуя с каким либо газообразным веществом, образует только газообразные продукты, которые после переноса в другую часть системы при изменении условий равновесия разлагаются с выделением вещества А.
Термодинамика испарения в однокомпонентной системе
Вследствие теплового движения молекул вещества частицы металла способны отрываться от поверхности жидкой или твердой фазы и переходить в газовую фазу. Возникают пары металла с определенным давлением (упругостью). Равновесное давление (упругость) пара P0i при данной температуре будет характеристикой данного металла.
Зависимость давления насыщенного пара от температуры определяет уравнение Клаузиуса-Клапейрона:
 (1)
(1)
где ΔV- изменение объема (Vж - Vпар);
q - теплота превращения (испарения) ,Дж/моль.
Если пренебречь объемом жидкости по сравнению с объемом пара и считать поведение пара как поведение идеального газа, то для одного моля
рVпар = RT. (2)
или
![]()
Тогда
![]() (3).
(3).
Давление насыщенного пара над диспергированной твердой или жидкой фазой и в капиллярно-пористых телах отличается от давления над плоской поверхностью при той же температуре. Эту зависимость выражает уравнение Томсона-Кельвина:

где P0дисп. и P0плоск. - давление насыщенного пара над диспергированным веществом или в капилляре и над плоской поверхностью соответственно;
σ - поверхностное натяжение конденсированной фазы на границе с газовой;
М - молекулярная масса дисперсной фазы (вещества);
ρ - плотность дисперсной фазы (вещества);
r - радиус дисперсной частицы вещества или капилляра (для капиллярно-пористых тел).
Таким образом, давление насыщенного пара в однокомпонентной системе и, соответственно, численное значение энергии Гиббса в однокомпонентной системе зависит, как минимум, от температуры и типа поверхности, над которой создается это давление.
Термодинамика испарения в двухкомпонентной системе
В бинарных системах равновесие жидкость-пар описывается общим термодинамическим уравнением состояния f(Р,Т,X) = 0, т.е. состояние системы зависит от давления, температуры и состава жидкости и пара. При постоянстве одного из указанных параметров уравнение f(Р,Т,X) = 0 упростится и примет вид изотермы Р = f(Х)T или изобары T = f(Х)P.
Возникает вопрос, как найти равновесное содержание компонента в жидкой газообразной фазах в зависимости от параметров системы.
Для бинарных систем, образованных компонентами А и В, состав равновесной с паром жидкой фазы («жидкость-идеальный раствор») можно определить, используя закон Рауля:

где PA, PB - парциальные равновесные давления пара компонентов А и В в паровой смеси;
P0A, P0B - давления насыщенного пара чистых компонентов А и В соответственно;
XжА, XжВ - мольные доли компонентов А и В в растворе (расплаве);
Робщ. - общее равновесное давление пара над раствором (расплавом).
отсюда
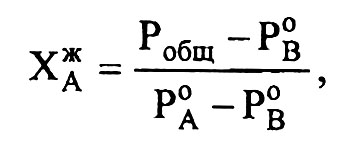
Таким образом, для нахождения состава равновесной жидкости при перегонке двухкомпонентной системы необходимо знать давления насыщенных паров чистых компонентов и Робщ.
Для определения состава пара, равновесного с жидкой фазой, воспользуемся уравнениями Рауля и Дальтона.
Закон Дальтона – давление смеси газов равно сумме их парциальных давлений.
Закон Рауля – парциальное давление компонента раствора, когда его доля близка к единице, равно произведению давления насыщенного пара чистого компонента на его мольную долю в растворе.
Отсюда
![]()
откуда мольная доля компонента А в равновесной паровой фазе:

где ХПА - мольная доля компонента А в равновесной паровой фазе.
Условия разделения металлов при испарении
Полнота разделения компонентов сплава при испарении определяется соотношением парциальных давлений паров компонентов над сплавом. Степень разделения компонентов равна отношению парциальных давлений (упругостей) паров над сплавом при температуре Т:
= (pА/pВ)т.
Если близка к 1, то разделить такие компоненты дистилляцией невозможно.
На рис. 137 представлена диаграмма зависимости давления паров металлов над двойными сплавами от состава.

Рис. 137. Диаграмма зависимости давления пара от состава для различных двойных сплавов:
1 - компоненты сплава не смешиваются в жидком состоянии; 2, 5 - расплавы с положительным отклонением от закона Рауля; 3, 6 — расплавы с отрицательным отклонением от закона Рауля; 4 - расплав, подчиняющийся закону Рауля, идеальный раствор
Кривая 1 относится к сплаву, компоненты которого не смешиваются в жидком состоянии, испарение каждой жидкости происходит независимо.
Кривые 2 и 3 характеризуют расплавы с положительными (2) и отрицательными (3) отклонениями от закона Рауля. Кривая 4 относится к идеальным растворам, для этого случая p1 = p10N1ж (РА = Р0АХжА) и р2 = p20N2ж (РВ = Р0ВХжВ), степень разделения описывается соотношением:

На практике перегонке подвергаются реальные растворы, в которых компоненты А и В взаимодействуют между собой, вследствие чего имеют место положительные, отрицательные или знакопеременные отклонения от закона Рауля.
Выход равновесных фаз при перегонке может быть определен графически с помощью фазовых диаграмм Ж-Пар по правилу рычага.

Рис. 6.8. Изменение состава жидкой и паровой фаз при ректификации раствора
На рис. 6.8 представлена фазовая диаграмма состояния системы А-В в координатах Х-Т. При нагреве исходной жидкости до температуры t1 часть жидкости испарится, обогатится легкокипящим компонентом А, а жидкая фаза - высококипящим компонентом В. Если пар охладить до температуры t2, то он частично сконденсируется, а оставшаяся паровая фаза еще более обогатится компонентом А. Для разделения жидкой фазы ее необходимо нагреть до t3. При более высокой температуре часть жидкости испарится, а оставшаяся жидкость обогатится высококипящим компонентом В.
Полученная путём испарения и конденсации фракция (дистиллят) обогащена более летучими (низкокипящими) компонентами, а неотогнанная жидкость (кубовый остаток) - тяжёлыми (высококипящими) компонентами.
Кинетические закономерности испарения (сублимации)
Скорость испарения жидкости пропорциональна площади свободной поверхности S и разности между давлением (упругостью) pп насыщенных паров при температуре испаряющейся жидкости и давлением (упругости) p паров, уже находящихся над жидкостью. Кроме того, эта скорость обратно пропорциональна давлению (упругости) pг постороннего газа, находящегося над жидкостью
![]() (1)
(1)
где С – постоянный множитель.
Выражение (1) больше соответствует понятию потока испаряющейся жидкости с данной фиксированной свободной поверхности S, чем понятию скорости испарения.
Для единицы свободной поверхности скорость испарения или конденсации (сублимации) вещества в вакууме может быть описана уравнением Лэнгмюра:
![]()
где α – коэффициент пропорциональности;
Мп -молекулярная масса вещества в паровой фазе, кг/моль;
Рi – равновесное парциальное давление насыщенного пара вещества;
Т – температура жидкости, К;
R – универсальная газовая постоянная.
При наличии стороннего газа в системе уравнение Лэнгмюра преобразуется к виду
![]()
где D – коэффициент диффузии, зависящий от давления стороннего газа и температуры;
r - радиус испаряющейся капли;
z – расстояние.
Из кинетических уравнений Ленгмюра следует, что скорость испарения компонента зависит от парциальных давлений компонентов бинарных смесей и мольных долей компонентов смесей. Для бинарных смесей степень разделения компонентов в условиях вакуума будет определяться соотношением

Кристаллизация из расплавов
Процессы кристаллизации имеют большое значение, так как образование слитков, методы выращивания кристаллов, способы зонной плавки и перекристаллизации значительно определяются характером и ростом кристаллов. Характерной чертой процесса кристаллизации является образование и рост зародышей новой фазы.
Из курса физической химии известно, что при равновесии химическое сродство, соответствующее фазовому переходу жидкость – твердая фаза, равно нулю:
A = μkL(p,T) - μkS(p,T) = 0
где μkL и μkS – химические потенциалы вещества к в двух фазах.
Т.е. при равновесии
μkL(p,T) = μkS(p,T)
При понижении температуры жидкости ниже температуры плавления ее молярная свободная энергия становится больше молярной свободной энергии твердой фазы. Система при понижении температуры становится неустойчивой (в данном случае переохлажденной). Это является термодинамическим условием появления твердой фазы.
Неустойчивое состояние, в котором системы может находиться длительное время, не переходя в равновесное состояние, называется метастабильным состоянием.
Выделяющиеся из системы, находящейся в метастабильном состоянии твердые фазы могут быть стабильными (равновесными, кристаллическими) или метастабильными (неравновесными, аморфными).
Важным моментом в теории фазовых переходов являются условия, при которых происходит возникновение зародышей новой фазы.
Закономерности образования зародышей новой фазы из расплавов
Различают два механизма образования новой фазы:
Гомогенный – зародыш новой фазы образуется в объеме старой;
Гетерогенный – зародыш образуется на межфазной границе.
1. Гомогенное зародышеобразование теоретически возможно при отсутствии внешнего воздействия – зародыши новой фазы могут возникать спонтанно за счет флуктуаций (например, тепловых).
Флуктуацией (от лат. fluctuatio - колебание) называются случайные отклонения наблюдаемых физических величин от их средних значений.
Современная физическая химия отводит различную роль флуктуациям в равновесной и неравновесной термодинамике.
Характерной особенностью равновесной системы является существование принципов экстремумов. Например, для изолированных систем энтропия возрастает и достигает максимума в состоянии равновесия. Поэтому за флуктуацией, приводящей к отклонению от равновесия, следует отклик (реакция), возвращающий систему в экстремум термодинамического потенциала.
В неравновесных системах флуктуации могут усиливаться необратимыми процессами и приводить к новым пространственно-временным структурам, называемым диссипативные структуры. Диссипативными структурами являются, например, аморфные, чаще всего метастабильные фазы.
Диссипативные структуры – новые пространственно-временные образования, которые могут возникать в сильно неравновесных ситуациях.
В гомогенных условиях зародыши новой фазы (капли жидкости в паре, кристаллики в жидкости, пузырьки газа в расплаве) становятся устойчивыми только после достижения ими критического размера. Пока зародыш не достиг критического размера, его рост сопровождается увеличением свободной энергии. Т.е. при возникновении и росте зародыша затрачивается работа на образование и увеличение поверхности раздела: зародыш – старая фаза.
Пусть GL и GS. молярные энергия Гиббса жидкого и твердого металла при температуре плавления (затвердевания). Объем зародыша обозначим V, а его поверхность - S и поверхностное натяжение на границе жидкость – зародыш - σ. Изменение свободной энергии при образовании зародыша, представляющего собой сферу радиусом r, складывается из двух частей, характеризующих появление зародыша объема V и образования и увеличения поверхности раздела S.
Изменение свободной энергии при образовании зародыша:
∆G
=
![]() (1)
(1)
где р - плотность твердого металла; М - мольная масса металла; S- поверхность.
При температуре выше точки плавления GS > GL величина ∆G > 0 и зародыши твердой фазы не образуются.
Когда температура жидкости становится ниже точки плавления, то GS < GL и появляется возможность самопроизвольной кристаллизации, т.е. ∆G < 0. Но если радиус зародыша меньше некоего критического размера, на его рост должна затрачиваться работа (ее величина растет с увеличением радиуса) и при отсутствии затрачиваемой работы зародыш должен исчезнуть. Благодаря В результате роста зародыша в переохлажденной до определенной температуры жидкости ∆G растет, но при некотором критическом значении rкр величина ∆G достигает экстремального значения, а затем падает, как это видно из рис.
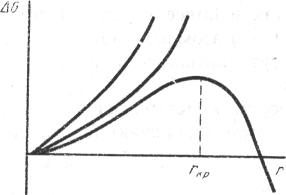
Рис. Зависимость ∆G от радиуса зародыша
Зародыши, имеющие размер меньше rкр должны самопроизвольно исчезать. Увеличение r более rкр приводит к снижению ∆G, зародыши оказываются устойчивыми.
Радиус
критического зародыша может быть найден
из условия, что в максимуме
![]() и при r
= rкр:
и при r
= rкр:
![]() или
или
![]()
Величина ∆G также может быть выражена через изменение теплоты плавления (или кристаллизации) ∆Нпл и энтропии ∆Sпл:
∆G = ∆Нпл - Т∆Sпл:
При
температуре плавления ∆G
= 0 и
![]() .
.
Принимая, что при небольших переохлаждениях ∆Нкр не зависит температуры, определим, что
![]()
где ∆Т- переохлаждение жидкости.
Подставляя в уравнение для rкр., получим
![]() (2).
(2).
Так для железа при ΔТ = 280 К rкр = 1,3 нм.
Изменение энергии Гиббса при формировании зародыша критического размера (работа образования зародыша критического размера) ∆Gкр может быть найдена из уравнений (1) и (2), а именно:

2. Гетерогенное зародышеобразование т.е. создание зародыша на уже имеющейся границе раздела (стенки реакционной емкости загрязнения т.п.) является более вероятным.
При гетерогенном зародышеобразовании изменение энергии Гиббса при формировании зародыша критического размера (работа образования критического зародыша) ∆G’кр. существенно ниже, чем при гомогенном, особенно, если новая фаза достаточно хорошо смачивает твердую поверхность.
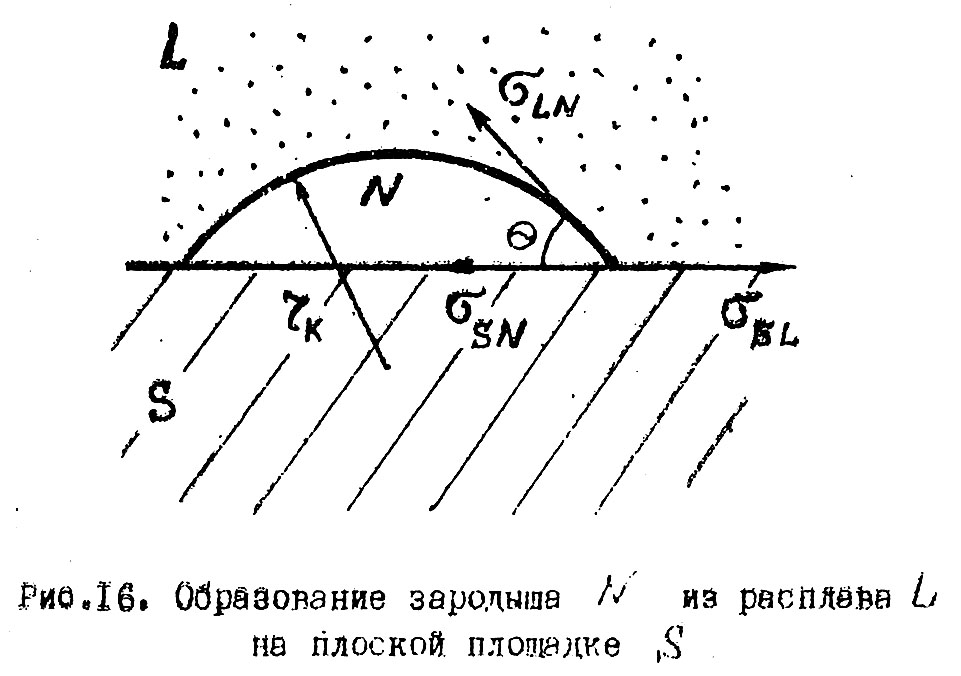
Если значение критического радиуса при гомогенном и гетерогенном образовании зародыша одинаковы, то энергии Гиббса при образовании (гомогенном и гетерогенном) связаны соотношением
![]() ,
,
где θ – угол смачивания.
Из уравнения следует, что чем меньше угол смачивания – θ, тем меньше работа образования критического зародыша - ∆G’кр..
Допустим, образование зародыша происходит из расплава на плоской поверхности. Работа образования зародыша критического размера ∆Gкр. может быть найдена из уравнения

Аморфные металлические материалы
Из курса коллоидной химии известно, что чем выше пересыщение раствора (расплава), достигаемое, например, переохлаждением, тем больше вероятность получение в твердой фазе аморфного продукта.
Аморфные (от греческого amorpos – бесформенный) металлы и сплавы – новый класс материалов, отличающихся от обычных металлов отсутствием упорядоченности расположения атомов, свойственным кристаллическим металлам и сплавам.
Аморфные металлические материалы являются диссипативными структурами. Т.е эти материалы получаются в сильнонеравновесных условиях, которые сильно отличаются от близких к равновесным.
В неравновесных ситуациях можно получать материалы, обладающие уникальными прикладными свойствами.
Аморфные металлы и сплавы могут обладать, по сравнению кристаллическими материалами специфическим сочетанием физико-химических свойств - высокой прочностью, твердостью, хорошей устойчивостью при сгибе, высоким электрическим сопротивлением, высокой магнитной проницаемостью, коррозионной устойчивостью и устойчивостью против радиации.
На первый план при получении данных материалов выходят кинетические факторы: скорость охлаждения (расплава), вязкость расплава и ее зависимость от температуры, скорость возникновения новых частиц и др.
В зависимости от соотношения скоростей роста зародышей новый фазы и образования новых зародышей в выделившейся из растворов твердой фазе будет преобладать кристаллические или аморфные структуры.
Лимитирующей стадия в любом случае зависит от величины пересыщения, поскольку от этой величины зависит и скорость кинетической стадии и скорость диффузионной стадии:
Скорость кинетической
стадии:
![]()
Скорость диффузионной
стадии:
![]()
Полная аморфизация достигается при такой скорости охлаждения , при которой в объеме жидкости не образуется ни одного зародыша критического размера. Т.е. этот критерий учитывает ограниченность роста зародышей.
Основную массу аморфных сплавов выпускают сейчас в виде тонких лент (шириной до 100-150 мм и толщиной 20-40 мкм). Аморфную ленту используют для изготовления высокоэффективных магнитных экранов, трансформаторов, бритвенных лезвий и др.
Методы получения аморфных материалов условно можно разделить на три группы:
Охлаждение со сверхвысокими скоростями (105-107 град/с) расплавленного металла (закалка из жидкого состояния – сверхбыстрое закаливание).
Охлаждение металлов из газовой (паровой) фазы на охлаждаемую подложку (термическое испарение, ионное испарение, плазменное напыление и т.д.).
Разрушение кристаллической структуры твердого тела за счет внешних воздействий (ионная имплантация).
Ликвационные и кристаллизационные методы рафинирования
Ликвация и кристаллизация используются в качестве приемов очистки металлов от примесей (рафинирования). Это обусловлено тем, что в процессе ликвации и кристаллизации происходит перераспределение примесей (растворимых и нерастворимых), присутствующих в металле.
Сущность ликвационных методов
Под ликвацией понимается нарушение однородности расплава, протекающее в жидком или затвердевающем металле.
Ликвационный метод предусматривает охлаждение гомогенного рафинируемого расплава до определенной температуры и длительную выдержку при ней, при этом происходит выделение одной или нескольких фаз в жидком или твердом виде, одна из которых оказывается обогащенной примесью. Выделенные фазы вследствие различия плотностей с течением времени отделяются друг от друга. Т.е. движущей силой ликвации в расплаве является гравитационное поле.
Возможность осуществления того или иного ликвационного процесса следует из особенностей строения диаграмм состояния: «рафинируемый металл-примесь». Исходя из диаграмм состояния, можно выявить температурные условия, обеспечивающие достаточную полноту удаления примеси, а также количественные соотношения фаз, которые получаются в процессе ликвационного рафинирования.
Сущность кристаллизационных методов очистки металлов и полупроводниковых материалов
Кристаллизационные методы для очистки металлов и полупроводников применяются на конечной стадии рафинирования с целью удаления из расплава очень малых концентраций примесей.
К кристаллизационным методам относятся:
