
- •Глава 1.Взаимодействие биополимеров с лигандами и между собой
- •1.1.Термодинамика взаимодействия биополимеров с лигандами
- •1.1.1.Взаимодействие биополимеров с недостатком лиганда
- •1.1.2.Взаимодействие биополимера с избытком лиганда
- •1.1.3.«Направленные» конформационные переходы
- •1.1.4.Кооперативное связывание лигандов
- •1.2.Биологическое «узнавание»
1.1.3.«Направленные» конформационные переходы
Выше мы рассматривали взаимодействие лиганда с биополимером, имеющим независимые центры связывания, когда (в случае однотипных мест связывания) присоединение первого лиганда никак не влияет на константу связывания второго. Однако часто связывание первого лиганда либо затрудняет (отрицательная кооперативность), либо облегчает (положительная кооперативность) присоединение второго. Поскольку лиганд ковалентно не взаимодействует с биомолекулой, т.е. не меняет ее химического строения, причиной кооперативности может быть только изменение пространственного строения (конформации) макромолекулы при связывании с лигандом.
Действительно, химически идентичные молекулы могут отличаться только конформацией. В то же время любые изменения каких-либо физических свойств или биологической функции биополимера могут быть вызваны только изменением его структуры, и если химические изменения. Исключены, то в рамках наших сегодняшних знаний не остается другого варианта, как приписать наблюдаемые изменения конформационному переходу.
Следует подчеркнуть, что констатация факта конформационного превращения и установление его природы — задачи совершенно разного порядка сложности. Прежде всего возникают два вопроса. Во-первых, каков механизм этого превращения (какими кинетическими и термодинамическими моделями он описывается)? Во-вторых, какие конкретные изменения взаимного расположения атомов в пространстве произошли в результате конформационного перехода?
Термодинамика конформационных переходов
Выше уже указывалось, что биополимеры имеют строго определенную нативную конформацию. Однако это не означает, что конформационные возможности нативной структуры ограничены одним жестким конформером. При биологически значимых температурах за счет тепловых движений происходят не только поступательные и вращательные движения биомолекулы как единого целого, но и колебания атомов и вращения вокруг отдельных связей внутри молекулы. Эти внутримолекулярные движения не выводят молекулу за пределы глобального минимума энергии и не изменяют ее биологическую функцию (см. Рис. 4 .6)
Рис.
4.6. Схематическое
представление профиля энергии в области
нативной конформации биополимера.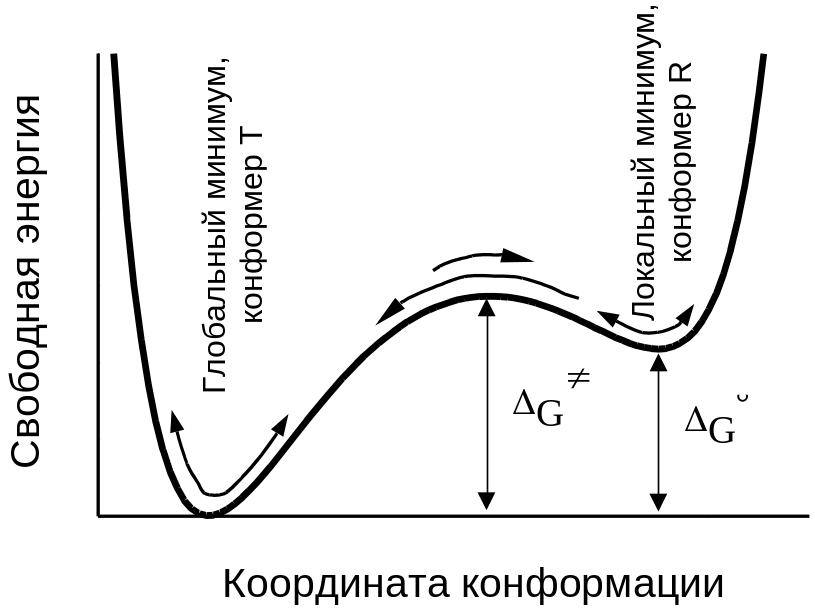
Соотношение конформеров (константа конформационного равновесия) не зависит от концентрации биополимера, но зависит от температуры, растворителя и присутствия в системе лиганда, который может связываться с конформерами.
Конформационный переход (часто его называют «направленным») трактуется как смещение равновесия в сторону менее стабильного (локального) конформера.
Конформационные переходы, происходящие при связывании с биополимером специфического лиганда, с этой точки зрения могут быть объяснены как результат резкого различия сродства этого лиганда к двум конформерам.
Действительно, пусть существуют два конформера R и T, которые находятся в равновесии (см. Рис. 4 .6):
![]()
( 4.0)
Поскольку конформер T обладает меньшей энергией (более стабилен) K < 1.
Связывание конформеров с лигандом описываются следующими соотношениями:
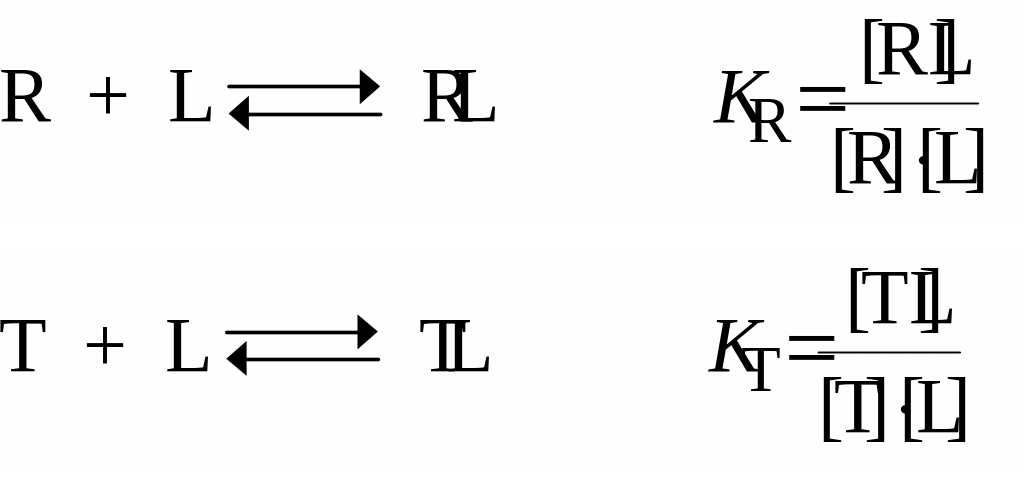
( 4.0)
Экспериментально измеряемые физические и биологические свойства биополимера определяются эффективной (кажущейся) константой равновесия, характеризующей отношение общего количества конформеров в смеси, вне зависимости от того, связаны ли они с лигандом или нет:
![]()
( 4.0)
Видно, что в отсутствии лиганда ([L] = 0) Kэфф равна K. С другой стороны, при [L] стремящейся к бесконечности Kэфф стремится к K(KR/KT).
![]()
( 4.0)
Сразу следует обратить внимание на принципиальное отличие эффективной (макроскопической) константы равновесия от истинной термодинамической (микроскопической) константы. Термодинамические константы не зависят от концентрации компонентов равновесия. В противоположность этому, кажущиеся константы могут зависеть от концентрации компонентов равновесия, поскольку они описывают не истинные термодинамические равновесия, а кажущиеся равновесия, содержание которых определяется экспериментально доступными данными.
Если сродство конформера R к лиганду настолько больше сродства конформера T, что KR/KT > K, то всегда существует концентрация лиганда, выше которой KT·[L] и KR·[L] > 1 и Kэфф будет больше 1. Другими словами, в равновесной смеси будет преобладать конформер R, т.е. экспериментально мы будем наблюдать конформационный переход от конформера T к конформеру R.
Рис.
4.7 Рассчитанная
кривая конформационного перехода при
связывании специфического лиганда.
Расчет проведен при следующих
микроскопических константах: K
= 0.005, KT = 100 M–1,
KR =
1·105
M–1.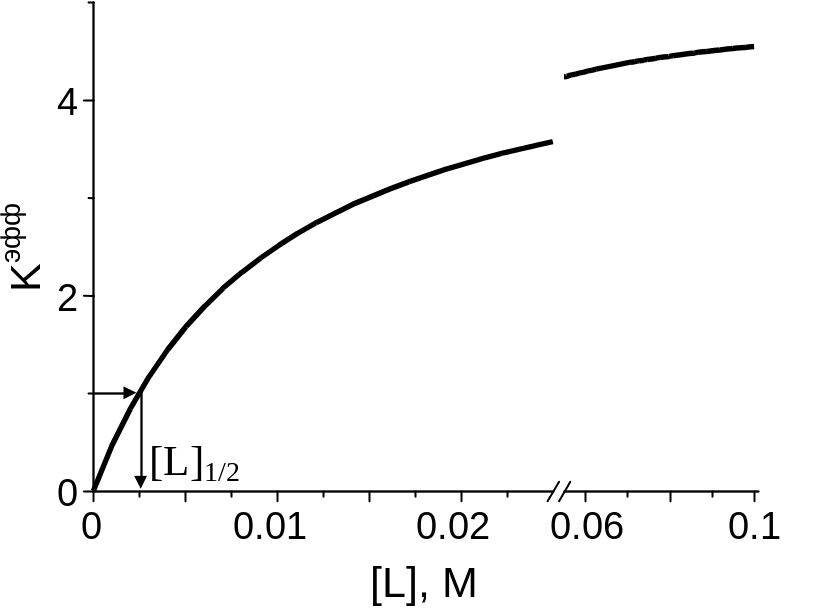
Концентрация полуперехода (концентрация лиганда при которой концентрации конформеров одинаковы и Kэфф = 1) равна:
![]()
( 4.0)
При концентрациях лиганда, меньших [L]1/2, в равновесной смеси преобладает конформер T, при больших — конформер R.
Конформационные переходы играют важную роль при функционировании ферментов и регуляции их активности, при взаимодействии гормонов с рецепторами и при активном транспорте веществ через клеточную мембрану. Эти процессы будут рассмотрены ниже. Наконец, конформационные изменения лежат в основе кооперативного связывания лигандов.
