
Поширення в природі
Оксиген — найпоширеніший на Землі елемент, вміст його становить 47% за масою (здебільшого у формі оксидів), у повітрі (тропосфері) кисню (O2) — 20,93% за об'ємом, або 23% за масою. До складу води входить 88,8 м.% Оксигену, в морській воді — 85,7 м.%. Він входить до складу більшості гірських порід, ґрунтів, а також клітин усіх рослинних і, тваринних організмів. Оксиген в цілому становить 30-85% маси тваринних і рослинних тканин. Він входить до складу білків, нуклеїнових кислот, жирів, вуглеводів тощо. Вільний кисень відіграє велику роль в біохімічних і фізіологічних процесах, зокрема в диханні. При недостаньому постачанні організму тварин і людини киснем розвивається гіпоксія. Зелені рослини і деякі бактерії є джерелом вільного кисню на Землі.
У Всесвіті Оксиген третій за поширеністю хімічний елемент після Гідрогену й Гелію.
Фізичні властивості
![]()
Рідкий кисень
Кисень — безбарвний газ без запаху і смаку. При температурі —183° С він скрапляється у рідину голубуватого кольору, яка при —218,7° С замерзає в синю кристалічну масу. Розчинність кисню у воді невелика і при звичайній температурі становить всього 3,1 см³ в 100 г води. У продаж кисень поступає в сталевих балонах під тиском приблизно 150 атм.
Твердий кисень (температура плавлення -218,79 °C) існує у вигляді синіх кристалів. Відомі шість кристалічних фаз, з яких три існують при тиску в 1 атм.:
α-О2 - існує при температурі нижче 23,65 K; яскраво-сині кристали відносяться до моноклінної сингонії, параметри комірки a = 5,403 Å, b = 3,429 Å, c = 5,086 Å; β = 132,53 ° [2].
β-О2 - існує в інтервалі температур від 23,65 до 43,65 К; блідо-сині кристали (при підвищенні тиску колір переходить в рожевий) мають ромбоедричну гратку, параметри комірки a = 4,21 Å, α = 46,25 ° [2].
γ-О2 - існує при температурах від 43,65 до 54,21 К; блідо-сині кристали мають кубічну симетрію , з періодоми решітки a = 6,83 Å [2].
Хімічні властивості

Окиснення натрію з типовим забарвленням полум'я
Оксиген належить до головної підгрупи шостої групи періодичної системи елементів. Його порядковий номер 8.
Молекула кисню складається з двох атомів. Хімічний зв'язок ковалентний: ·Ö··Ö·. Спрощена структурна формула: O = O. Основний стан молекули кисню триплетний, тобто молекула кисню — дирадикал. Два електрони утворюють ковалентний зв'язок, два інші — антизв'язану пару. Цим пояснюється те, що молекулярний кисень парамагнетик.
Існує також високоенергетична синглетна форма молекули кисню. Вона дуже хімічно активна, і швидко реагує з органічними сполуками. Синглетний кисень утворюється в процесі фотосинтезу, та імунною системою. Він також виникає у тропосфері внаслідок фотолізу озону.
Маючи у зовнішній електронній оболонці шість електронів, атоми Оксигену енергійно приєднують від атомів інших елементів два електрони, яких їм бракує для завершення валентної оболонки, і перетворюються в негативні двовалентні іони:
O + 2e = O2-
При цьому Оксиген проявляє свої окиснювальні властивості. Серед усіх хімічних елементів він є одним з найсильніших окисників і поступається в цьому тільки перед фтором. Оксиген безпосередньо сполучається з усіма елементами, за винятком інертних газів, галогенів і благородних металів. Хімічна активність кисню зростає з підвищенням температури.
![]()
Кисень добре розчинний в органічних розчинниках, поглинається тонкими порошками металів, вугілля. Утворює сполуки з усіма елементами, крім гелію, аргону і неону. На основі типів і властивостей кисневих сполук побудована класифікація неорганічних сполук. З металами й неметалами Оксиген утворює оксиди сполук, з лужними металами, крім літію, — пероксиди. Взаємодія речовин з Оксиген значно прискорюється при нагрівальній дії електричних розрядів, під тиском, при наявності каталізаторів, особливо води. В суміші з горючими газами й парою, з тонкими порошками багатьох металів й органічних речовин кисень-газ утворює вибухові суміші. Він легко окиснює органічні сполуки.
![]()
Отримання
У лабораторіях кисень звичайно одержують термічним розкладанням деяких пероксидів, солей, деяких кисневих кислот (наприклад, KMnO4, бертолетової солі — KClO3):
2KClO3 = 2KCl + 3O2 ↑
При 368 °C ця сіль плавиться, а близько 400 °C починає розкладатися. В присутності двокису марганцю MnO2 (каталізатор) температура розкладу знижується і реакція проходить легше.
У промисловості кисень добувають фракціонованою перегонкою рідкого повітря і електролізом води. З цією метою повітря спочатку скраплюють сильним охолодженням під великим тиском, а потім повільно випаровують з нього азот. Дуже чистий кисень добувають електролізом водного розчину гідроксиду натрію NaOH з застосуванням нікелевих електродів. При цьому на катоді відновлюються катіони Гідрогену, а на аноді окислюються гідроксильні аніони з виділенням кисню.
Електродні реакції можна позначити такими рівняннями:
Катод: 4H + 4e = 2Н2 ↑
Анод: 4ОН- — 4e = 2H2O + O2 ↑
Електролітичним способом кисень одержують і для промислових потреб, зокрема там, де є дешева електрична енергія.
21
Гідроге́н (Н) — хімічний елемент з атомним номером 1, що належить до 1-ої групи періодичної системи елементів. Проста речовина Гідрогену — во́день H2 — безколірний, без запаху і смаку газ, найлегший із усіх відомих газів.
Ізотопи гідрогену мають власні назви: 1H — протій (Н), 2H — дейтерій (D) і 3H — тритій (T).
Гідроген — один з основних компонентів всіх природних органічних сполук. Водень реагує з неметалами, з металами утворюються гідриди. Суміш водню з киснем (гримучий газ) вибухає при підпалюванні. Водень є відновником.
Сировина для промислового отримання водню — гази нафтопереробки, гази природні, продукти газифікації вугілля та інше. Основні лабораторні способи отримання водню: реакція вуглеводнів з водяною парою, неповне окиснення вуглеводнів, конверсія оксиду вуглецю, електроліз води.
Водень застосовують для синтезу аміаку, метилового спирту, в процесах гідрогенізації, при зварюванні і різанні металів тощо. Водень — перспективне газоподібне пальне. Дейтерій і тритій знайшли застосування в атомній енергетиці.
Поширення
У земній корі міститься біля 1 % за масою, або 17,25 атомних відсотки Гідрогену. Відносний вміст водню в атмосфері збільшується з висотою. На рівні моря він становить 0,00005 % за об‘ємом, верхні ж шари (вище 100 км) складаються в основному з нього. Вільний водень міститься в горючих газах, що виділяються із землі. Він виникає при гнитті і бродінні органічних речовин і тому міститься в кишкових газах людини і тварин. Основна маса Гідрогену знаходиться в зв‘язаному стані у вигляді різноманітних сполук. Найпоширенішими з них є вода, до складу якої входить 11,19 % Гідрогену. Відома велика кількість сполук Гідрогену з вуглецем (вуглеводні). Гідроген входить до складу нафти, кам‘яного вугілля, деяких мінералів.
У лабораторіях водень отримують дією кислот на метали, наприклад дією сірчаної кислоти на цинк:
H2SO4 + Zn = H2 + ZnSO4.
У техніці водень отримують:
з природного газу, що складається в основному з метану, який змішують з водяною парою та киснем і нагрівають до температури 800–900 °C в присутності каталізатора:
СН4 + О2 + 2Н2О = 2СО2 + 6Н2;
при електролізі розчинів хлориду натрію та хлориду калію як побічний продукт виробництва лугів, гіпохлоритів і хлоратів
Отримання
Промислові способи отримання простих речовин залежать від того, в якому вигляді відповідний елемент знаходиться в природі, тобто що може бути сировиною для його отримання. Так, кисень, наявний у вільному стані, отримують фізичним способом — виділенням з рідкого повітря. Водень практично весь знаходиться у вигляді сполук, тому для його отримання застосовують хімічні методи. Зокрема, можуть бути використані реакції розкладу. Одним із способів отримання водню є реакція розкладання води від дією електричного струму.
Основний промисловий спосіб отримання водню — реакція метану, який входить до складу природного газу, з водою. Вона проводиться при високій температурі:
СН4 + 2Н2O = CO2 ↑ + 4Н2 −165 кДж
Зазвичай в лабораторії водень отримують взаємодією цинку з соляною кислотою.
Фізичні властивості

Лінійчатий спектр видимого випромінювання атома водню
Водень — найлегший газ, він легший за повітря в 14,5 разів. Очевидно, що чим менше маса молекул, тим вище їх швидкість при одній і тій же температурі. Як найлегші, молекули водню рухаються швидше молекул будь-якого іншого газу і тим самим швидше можуть передавати теплоту від одного тіла до іншого. Звідси випливає, що водень має найвищу теплопровідність серед газоподібних речовин. Його теплопровідність приблизно в сім разів вище теплопровідності повітря.
Молекула водню складається з двох атомів Гідрогену — Н2. За нормальних умов, водень — це газ без кольору, запаху і смаку з густиною 0,08987 г/л (н.у.), температурою кипіння −252,76 °C, теплота згорянна 120,9 Дж/кг. Водень малорозчинний у воді — 18,8 мл/л. Але він добре розчиняється у багатьох металах (Ni, Pt, Pd тощо), особливо в паладії (850 об'ємів на 1 об'єм Pd). З розчинністю водню в металах пов'язана його здатність дифундувати через них; дифузія через вуглецевий сплав (наприклад, сталь) іноді супроводжується руйнуванням сплаву внаслідок взаємодії водню з вуглецем (так звана декарбонізація). Практично не розчинний в сріблі.
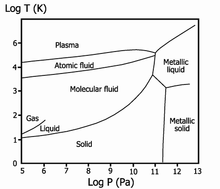
Фазова діаграма водню
Рідкий водень існує в дуже вузькому інтервалі температур від −252,76 до −259,2 °C. Це безбарвна рідина, дуже легка (густина при −253 °C — 0,0708 г/см3) і текуча (в'язкість при −253 °C — 13,8 пуаз). Критичні параметри водню дуже низькі: температура −240,2 °C і тиск 12,8 атм. Цим пояснюються труднощі при зрідженні водню.
Твердий водень має температуру плавлення −259,2 °C, густину 0,0807 г/см3 (при −262 °C) — білосніжна маса з кристалами гексагональної сингонії, просторова група — P6/mmc, з параметри комірки a = 0,378 нм і c = 0,6167 нм. При високому тиску водень переходить в металевий стан.
Хімічні властивості
Молекула водню складається із двох атомів. Хімічний звя'зок у молекулі водню — ковалентий неполярний, оскільки молекула утворена атомами з однаковою елетронегативністю (атомами одногу виду). Спільна електронна пара, що утворює зв'язок, знаходиться посередені між ядрами атомів. Через спільнення електронів молекула водню енергетично більш стійка, ніж атоми Гідрогену окремо.
Хімічний зв'язок у молекулі водню міцний. Щоб розірвати усі молекули водню у 1 молі простої речовини слід затратити енергію у 436 кДж, тому активність молекулярного водню за звичайної температури мала. Для розриву потрібна активація молекули — підвищення температури, електрична іскра, світло.
Взаємодія з неметалами
При підпалюванні чи в присутності платинового каталізатора водень реагує із киснем
O2 + 2H2 = 2H2O, реакція протікає із вибухом.
Суміш двох об'ємів водню та одного об'єму кисню називається гримучим газом.
При нагріванні водень зворотньо взаємодіє із сіркою :
S + H2 ⇔ H2S (сірководень)
З азотом — при нагріванні, підвищенні тиску та у присутності каталізатору (залізо):
N2 + 3H2 = 2NH3 (аміак)
З галогенами утворює галогеноводні:
F2 + H2 = 2HF, реакція протікає із вибухом за будь-якої температури,
Cl2 + H2 = 2HCl, реакція протікає тільки на світлі.
Із сажею водень взаємодіє при сильному нагріванні:
C + 2H2 = CH4 (метан)
Взаємодія із лужними та лужноземельними металами
Водень утворює із активними металами гідриди:
2Na + H2 = 2NaH (гідрид натрію)
Ca + H2 = CaH2 (гідрид кальцію)
Взаємодія із оксидами металів (як правило, d-елементів)
Оксид відновлюються до металів:
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Гідрування органічних сполук
При дії водню на ненасичені вуглеводні у присутності нікелевогокаталізатору та при підвищеній температурі, відбувається реакція гідрування:
CH2=CH2(етилен) + H2 = CH3-CH3 (етан)
Водень відновлює альдегіди до спиртів:
CH3CHO(оцтовий альдегід) + H2 = C2H5OH (етанол)
