
- •Аналитическая химия
- •Примерный тематический план
- •Введение
- •Самостоятельная работа студентов
- •Содержание дисциплины
- •Виды реактивов
- •Классификация катионов
- •Методы качественного анализа смеси ионов
- •Комплексные соли
- •Строение комплексных солей
- •Номенклатура комплексных солей
- •Лабораторные работы
- •Тема 1.2. Анионы
- •Лабораторная работа
- •Тема 1.3. Анализ солей
- •Анализ соли
- •Предварительные испытания
- •Растворение
- •Анализ катиона и аниона Методика анализа соли, растворенной в воде
- •Растворение соли
- •Определение групповой принадлежности катиона
- •Открытие катиона
- •Удаление катиона
- •Определение групповой принадлежности аниона
- •Открытие аниона
- •Лабораторная работа
- •Раздел 2. Оценка достоверности аналитических данных
- •Пример обработки результата
- •Лабораторная работа
- •Раздел 3. Количественный анализ
- •Методы количественного анализа (химические)
- •Тема 3.1. Гравиметрический анализ
- •Операции гравиметрического анализа
- •Посуда общего назначения
- •Специальная посуда
- •Оборудование
- •Пример выбора осадителя
- •Весы и взвешивание. Устройство аналитических весов.
- •Техника взвешивания
- •Меняют нагрузку только на выключенных весах.
- •Расчет процентного содержания вещества в анализируемом образце
- •Пример определения фактора пересчета
- •Пример расчета процентного содержания вещества в анализируемом образце
- •Лабораторная работа
- •Тема 3.2. Титриметрический анализ
- •Практические занятия
- •Способы титрования
- •Мерная посуда
- •Основные составляющие титриметрической системы
- •Техника титрования Вычисления в титриметрическом анализе Теоретические основы
- •Примеры расчетов
- •Тема 3.2.1. Кислотно-основное титрование
- •Вычисление водородного и гидроксидного показателя кислот и оснований
- •Лабораторные работы
- •Тема 3.2.2. Метод окисления-восстановления (оксидиметрия)
- •Молярная масса эквивалента окислителей и восстановителей
- •Лабораторные работы
- •Практическое занятие
- •Тема 3.2.3. Метод комплексонометрии
- •Лабораторная работа
- •Раздел 4. Физико-химические методы анализа Введение
- •Тема 4.1. Колориметрический метод анализа
- •Основной закон поглощения света
- •Методы определения концентрации
- •Тема 4.2. Хроматографический метод анализа
- •Виды хроматографии
- •Лабораторная работа
- •Тема 4.3. Рефрактометрический метод анализа
- •Показатель преломления
- •Лабораторные работы
- •Тема 4.4. Потенциометрический метод анализа
- •Потенциометрическое титрование
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Рекомендуемая литература
- •Дополнительная литература
Удаление катиона
Если катион не относится к VI группе, он мешает открытию аниона и его нужно удалить. Для этого раствор соли помещают в тигель, приливают избыток карбоната натрия, нагревают (не до кипения). При этом катион соли выпадает в осадок. Раствор с осадком приносят в центрифужную пробирку и центрифугируют. Осадок отбрасывают, а к раствору, который называют «содовой вытяжкой» приливают при нагревании уксусную кислоту до прекращения выделения пузырьков газа. Это необходимо для удаления из раствора избытка карбонат-ионов.
Na2CO3 + CH3COOH
Полученный раствор делят на три пробирки.
Определение групповой принадлежности аниона
К раствору, полученному после удаления катиона (если удаление катиона не проводилось, то к раствору соли) приливают: в одну пробирку 2N раствор хлорида бария, во вторую 2N раствора нитрата серебра и по таблице анионов определяют, к какой группе принадлежит анион.
Открытие аниона
Выполняют с помощью характерных реакций на анионы данной группы. Для исследования используют раствор, полученный в IV операции, находящийся в третьей пробирке (или раствор соли, если удаление катиона не проводилось).
По окончании работы составляют формулу соли.
Лабораторная работа
1. Проведение анализа соли, растворимой в воде
Раздел 2. Оценка достоверности аналитических данных
Студент должен:
иметь представление:
о типах ошибок в анализе;
о точности метода (дисперсия, стандартное отклонение);
о доверительном интервале;
о доверительной вероятности.
Абсолютные и относительные ошибки. Случайные погрешности. Доверительный интервал. Стандартное отклонение среднего результата. Методы математическорй обработки результатов анализа.
При выполнении анализа возможны ошибки:
Грубые ошибки (результат небрежной работы) – их выявляют и устраняют
Систематические ошибки – зависят от особенности метода анализа (недостаточной точности весов, разновесов, загрязненности реактивов) – их устраняют или вводят поправки.
Случайные ошибки зависят от помех несовершенства приборов и органов чувств, а также внешних условий (загрязненности воздуха, колебания температуры и влажности) – их можно уменьшить, увеличив число параллельных опытов.
Влияние случайной ошибки на конечный результата можно уменьшить путем обработки результата анализа, методами статистики. Для этого вычисляют:
Абсолютная ошибка – это разность между истинным значением величины и найденным.
![]()
Относительная ошибка – это отношение абсолютной ошибки к истинному значению.
![]()
Обработка результата анализа производится в следующем порядке:
среднее арифметическое значение
![]()
где n – число опытов.
определяют отклонение каждого результата от среднего
![]()
![]()
![]()
дисперсия (разброс), V

определение стандартного отклонения S
![]()
Дисперсия и стандартное отклонение характеризуют точность анализа, чем меньше эти величины, тем точнее анализ.
Если из-за ошибок измерения истинной величины невозможно, то находят интервал значений, в котором находится истинная величина. Его называют доверительным интервалом.
![]()
ta – коэффициент Стьюдента. Определяется по таблице в зависимости от доверительной вероятности и числа степеней свободы.
Доверительная вероятность (d) – задается экспериментаторами, обычно d=0,95 или d=0,99
Таблица 3 - Коэффициент нормированных отклонений (при малом числе наблюдений) t; k
k=n – 1 |
|
||
0,95 |
0,99 |
0,999 |
|
1 |
12,706 |
63,657 |
636,619 |
2 |
4,303 |
9,925 |
31,598 |
3 |
3,182 |
5,841 |
12,941 |
4 |
2,776 |
4,604 |
8,610 |
5 |
2,571 |
4,032 |
6,859 |
6 |
2,447 |
3,707 |
5,959 |
7 |
2,365 |
3,499 |
5,405 |
8 |
2,306 |
3,355 |
5,041 |
Число степеней свободы k
k = n – 1
истинное значение определенной величины
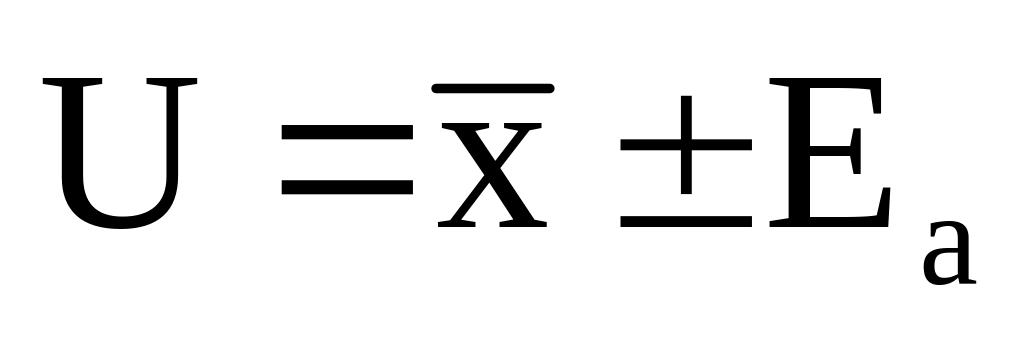
![]()
