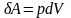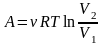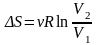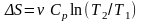- •1. Содержание программы курса «Молекулярная физика»
- •6. Контрольные вопросы к экзамену
- •Уравнение теплопроводности и диффузии, зависящие от времени. Граничные и начальные условия. Расчет распределения тепла между пластинами, вокруг нагретой сферы и цилиндра.
- •Осмотическое давление. Кипение растворов с нелетучим и летучим компонентом.
- •1. Тесты на знание формул к экзамену.
- •Справочник для подготовки к экзамену и Интернет-экзамену по курсу «Молекулярная физика». Идеальные газы
- •Молярные массы некоторых газов.
- •Смеси идеальных газов.
- •Процессы в газах
- •Явления переноса в идеальных газах
- •Фазовые переходы и капиллярные явления.
- •9. Капиллярные явления.
Процессы в газах
Процесс |
Уравнение процесса |
Теплоемкость С |
Изотермический
|
|
С = |
Изобарный
|
|
|
Изохорный
|
|
|
Адиабатический =0 процесс без теплообмена |
= Ср/СV = (i+2)/ i - показатель адиабаты |
С = 0 |
Политропический С = const процесс с постоянной теплоемкостью |
n=(C-Ср)/(C-СV) - показатель политропы |
С
=
где n - показатель политропы |
процесс |
Работа
|
Теплота Q = СdT Q = СT |
Внутренняя энергия dU = СV dT |
Энтропия dS = Q/T |
Изотермический |
|
Q = A |
U =0 |
|
Изобарный |
A = (Cp - СV)T = R T |
Q = Сp T |
U = СV T |
|
Изохорный |
A=0 |
Q = СVT |
U = СV T |
|
Адиабатический |
A = -U |
Q = 0 |
U = СV T |
S =0 |
Политропический |
A = (C- СV) T |
Q = СT |
U = СV T |
|
Коэффициент полезного действия тепловой машины = А/ Q1 =(Q1 - Q2)/Q1),
Q1 >0 – полученное, Q2 <0 – отданное машиной тепло в ходе цикла.
Коэффициент полезного действия цикла Карно = (T1-T2)/T1
Т1 – температура нагревателя, Т2 – температура холодильника.
Явления переноса в идеальных газах
1.
Среднее число столкновений молекул за
время
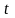 =1сек:
Z=
=1сек:
Z=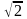
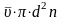
и
средняя длина свободного пробега
молекул:
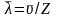 =
=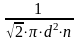 ,
,
где
d
– эффективный
диаметр молекул, n
– их число в единице объема,
 =
=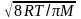 -
среднеарифметическая скорость молекулы.
-
среднеарифметическая скорость молекулы.
2. Явление диффузии – перенос количества молекул:
In
= - D
·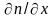 ;
где D=
;
где D=
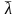 /3
– коэффициент
диффузии,
In=dN/(dS·dt)
- поток
молекул,
- градиент концентрации.
/3
– коэффициент
диффузии,
In=dN/(dS·dt)
- поток
молекул,
- градиент концентрации.
3.
Явление теплопроводности
– перенос энергии:
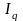 =-
=-
 ;
где
=cV
;
где
=cV
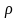 /3-
коэффициент
теплопроводности,
- плотность
газа,
/3-
коэффициент
теплопроводности,
- плотность
газа,
сV - удельная теплоемкость, - градиент температуры, - поток энергии.
4. Явление внутреннего трения (вязкость)– перенос импульса направленного движения:
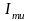 =
-
=
-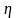 du/dx;
где
=
/3
- коэффициент
динамической вязкости, du/dx
- градиент скорости направленного
движения,
- поток импульса.
du/dx;
где
=
/3
- коэффициент
динамической вязкости, du/dx
- градиент скорости направленного
движения,
- поток импульса.
Фазовые переходы и капиллярные явления.
1. Уравнение Ван-дер-Ваальса: (p + av2 / V2) (V – v b) = RT
П араметр
a
– характеризует силы притяжения между
молекулами, b
- силы отталкивания и размеры молекул.
араметр
a
– характеризует силы притяжения между
молекулами, b
- силы отталкивания и размеры молекул.
На изотерме при Т1 на приведенном рисунке:
DD′ – жидкое состояние вещества;
AA′ - газообразное состояние вещества;
D
Изотермы Ван-дер-Ваальса.
FA – двухфазное состояние вещества (на данном участке осуществляется фазовый переход жидкость – газ); DC и BA- метастабильные состояния, DC – перегретая жидкость; BA- пересыщенный пар.2. При критической температуре Ткр. исчезает различие между жидкостью и газом, а область фазового перехода вырождается в точку перегиба. При T> Ткр. – только газообразное состояние вещества.
3. Критические параметра вещества: Vкр.=3b; pкр.= a / 27b2 ; Ткр. =8a / 27Rb.
4. Приведенное уравнение Ван-дер-Ваальса: ( + 3 / 2) (3 - 1) = 8
где = p/ pкр ; = V / Vкр ; = T / Tкр .
5. Равновесие фаз достигается при равенстве потенциалов Гиббса G=U+PV-TS этих фаз (dG = Vdp – SdT).
6.
Фазовые переходы I
рода
сопровождаются скачком первых производных
от G:
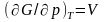 ;
;
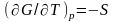 .
Поэтому
такие переходы сопровождаются скачком
удельного объема (плотности) и выделением
(или поглощением) тепла.
.
Поэтому
такие переходы сопровождаются скачком
удельного объема (плотности) и выделением
(или поглощением) тепла.
7.
Фазовые переходы II
рода
сопровождаются скачком вторых производных
от G:
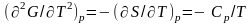 ;
;
 ;
;
 .
Поэтому
они сопровождаются скачком теплоемкости,
а также коэффициентов изотермической
сжимаемости
.
Поэтому
они сопровождаются скачком теплоемкости,
а также коэффициентов изотермической
сжимаемости
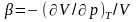 и
объемного расширения
и
объемного расширения
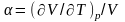 ,
при этом плотность изменяется монотонно
и непрерывно, выделения или поглощения
тепла не происходит.
Примеры
фазовых переходов II
рода:
парамагнетик – ферромагнетик и диэлектрик
- сегнетоэлектрик, сопровождаемые
появлением макроскопического
магнитного
момента и спонтанной поляризации у
вещества; переход металлов и сплавов
из нормального в сверхпроводящее
состояние; переход жидкого гелия в
сверхтекучее состояние и т.д.
,
при этом плотность изменяется монотонно
и непрерывно, выделения или поглощения
тепла не происходит.
Примеры
фазовых переходов II
рода:
парамагнетик – ферромагнетик и диэлектрик
- сегнетоэлектрик, сопровождаемые
появлением макроскопического
магнитного
момента и спонтанной поляризации у
вещества; переход металлов и сплавов
из нормального в сверхпроводящее
состояние; переход жидкого гелия в
сверхтекучее состояние и т.д.
7.
Фазовые
переходы I
рода между
тремя фазами вещества: газообразным
(1), жидким (2) и твердым (3) (испарение и
конденсация, плавление и кристаллизация,
сублимация и возгонка) описываются
уравнением Клапейрона- Клаузиуса:
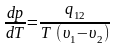 >0;
>0;
 >0;
>0;
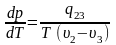 ,
,
где q - удельная теплота фазового перехода, - удельный объем вещества.
Для
фазовых переходов газжидкость
(12)
и газтвердое
тело (13)
производные dp/dT
положительны
для всех
веществ. Для большинства веществ d p/dT>0
и при фазовых переходов жидкостьтвердое
тело - такие вещества называются
нормальными. Однако имеются и аномальные
вещества (например, вода и лед), д
p/dT>0
и при фазовых переходов жидкостьтвердое
тело - такие вещества называются
нормальными. Однако имеются и аномальные
вещества (например, вода и лед), д
Фазовые диаграммы.
ля которых dp/dT<0, т.к для них .
.
8. Фазовые диаграммы – геометрическое изображение фазового состояния системы в зависимости от температуры Т и давления p – смотри рисунок. Каждая точка на кривых фазовой диаграммы соответствует условию равновесия между двумя фазами. Вдоль кривых вещество находится в двухфазном состоянии, вне кривых – в однофазном: S–твердом (Solid), L–жидком (Liquid), G–газообразном (Gas).
ОК – кривая испарения или конденсации, заканчивается при Tкр.
ОВ – кривая плавления или кристаллизации для нормальных веществ, ОВ′- для аномальных. Для нормальных веществ при увеличении давления температура плавления повышается, а для аномальных, наоборот, понижается.
АО – кривая возгонки или сублимации. О– тройная точка – равновесие трех фаз.

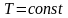
 ,
,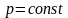
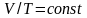
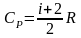
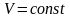
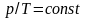
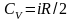
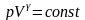 ;
;
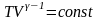
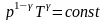
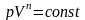 ;
;
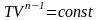
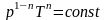
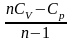 ,
,