
- •1.Характеристика фосфорной кислоты
- •2.Характеристика сырья
- •3. Способы получения фосфорной кислоты в промышленности
- •4. Физико-химические способы экстракционного способа получения фосфорной кислоты
- •5. Описание процесса получения фосфорной кислоты
- •6. Конструкция и принцип работы двухступенчатого экстрактора
- •7. Экология в производстве фосфорной кислоты
- •8. Практическая часть
- •8.1. Составления материального баланса производства экстракционной фосфорной кислоты
- •8.2. Составление теплового баланса процесса экстракции фосфорной кислоты
- •9. Список литературы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАТИВНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«МАГНИТОГОРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Г.И. Носова»
Химико-металлургический факультет
Кафедра ХТиФХ
Курсовая работа по ОХТ
Тема: «Экстракционное получение фосфорной кислоты»
Студент: Ощепков Б.М.,курс 3,группа МХТ-09 __________________
Руководитель: доц.,к.т.н Крылова С.А. _________________
Работа допущена к защите « » 2012г.
Работа защищена « » 2012г.
С оценкой подпись
Магнитогорск
2012
СОДЕРЖАНИЕ:
1.
1.Характеристика фосфорной кислоты
Фосфорная кислота H3PO4, бесцветные гигроскопические кристаллы , с плотностью 1,88 г/мл. Температура плавления 42,5оС; ∆Нообр = -1283кДж/моль. Расплывается на воздухе. Наиболее стабильное в ряду кислородосодержащих кислот фосфора. В расплавленном состоянии склонна к переохлаждению; при 15оС образует густую маслянистую жидкость, а при - 121оС – стеклообразную массу.
Фосфорная кислота смешивается с водой в любых соотношениях. Из высококон-центрированных растворов кристаллизуется в виде гемигидрата (полугидрата) H3PO4*1/2Н2О, представляющее собой бесцветные кристаллы. Молекула безводной H3PO4 и её кристаллогидрата содержит тетраэдрическую группу PO4. В безводной фосфорной кислоте образуются водородные связи типа Р-О-Н…О≡Р (рис.1), которые удерживают в виде слоев, параллельных одной из плоскостей кристалла. Водородные связи сохраняются в концентрированных (70-80%) растворах фосфорной кислоты. В разбавленных (до 40-50%) растворах отмечена более устойчивая водородная связь фосфат-анионов с молекулами воды, а не другими фосфат-анионами. В водных растворах фосфорной кис-лоты существует обмен атомами кислорода между группами РО4 и водой.


Рис.1 Водородные связи в молеку-лярных структурах Н3РО4. …- водородная связь
Рис.2 Фазовая диаграмма Н3РО4 – Н2О (Ж – жидкая фаза)
H3PO4 – сильная кислота, К1 = 7,1*10-3, К2 = 6,2*10-8, К3 = 5,0*10-13; значения К1 и К2 зависят от температуры. Диссоциация по первой ступени экзотермична, по второй и третьей – эндотермична. Фазовая диаграмма H3PO4 – вода приведена на рис.2, из которой видно, что максимум кривой кристаллизации находится при температуре 302,4 К и кон-центрация кислоты 91,6% , а твердая фаза – гемигидрат.
В табл.1 приведены свойства водных растворов фосфорной кислоты. Плотность 100%-ной фосфорной кислоты при 15° С составляет 1,8829 г/см3.
Таблица 1 – Свойства водных растворов фосфорной кислоты
Содержание,% (масс.) |
Температура затвердевания, °С |
Температура кипения, °С |
с;, кДж/(кг*К) |
ῃ, Па-с (25° С) |
Удельная электрическая проводимость, Ом/м (25° С) |
Давление пара, Па (25° С) |
|
н,ро4 |
Р205 |
||||||
5 |
3,62 |
0,8 |
100,10 |
4,0737 |
0,0010 |
10,0 |
3129,1 |
10 |
7,24 |
-2,10 |
100,20 |
3,9314 |
0,0011 |
18,5 |
3087,7 |
20 |
14,49 |
-6,00 |
100,80 |
3,6467 |
0,0016 |
18,3 |
2986,4 |
30 |
21,73 |
-11,80 |
101,80 |
3,3411 |
0,0023 |
14,3 |
2835,7 |
40 |
28,96 |
-21,90 |
103,90 |
3,0271 |
0,0035 |
11,0 |
2553,1 |
50 |
36,22 |
-41,90 |
104,00 |
2,7465 |
0,0051 |
8,0 |
2223,8 |
60 |
43,47 |
-76,90 |
114,90 |
2,4995 |
0,0092 |
7,2 |
1737,1 |
70 |
50,72 |
-43,00 |
127,10 |
2,3278 |
0,0154 |
6,3 |
1122,6 |
75 |
54,32 |
-17,55 |
135,00 |
2,2692 |
0,0200 |
5,8 |
805,2 |
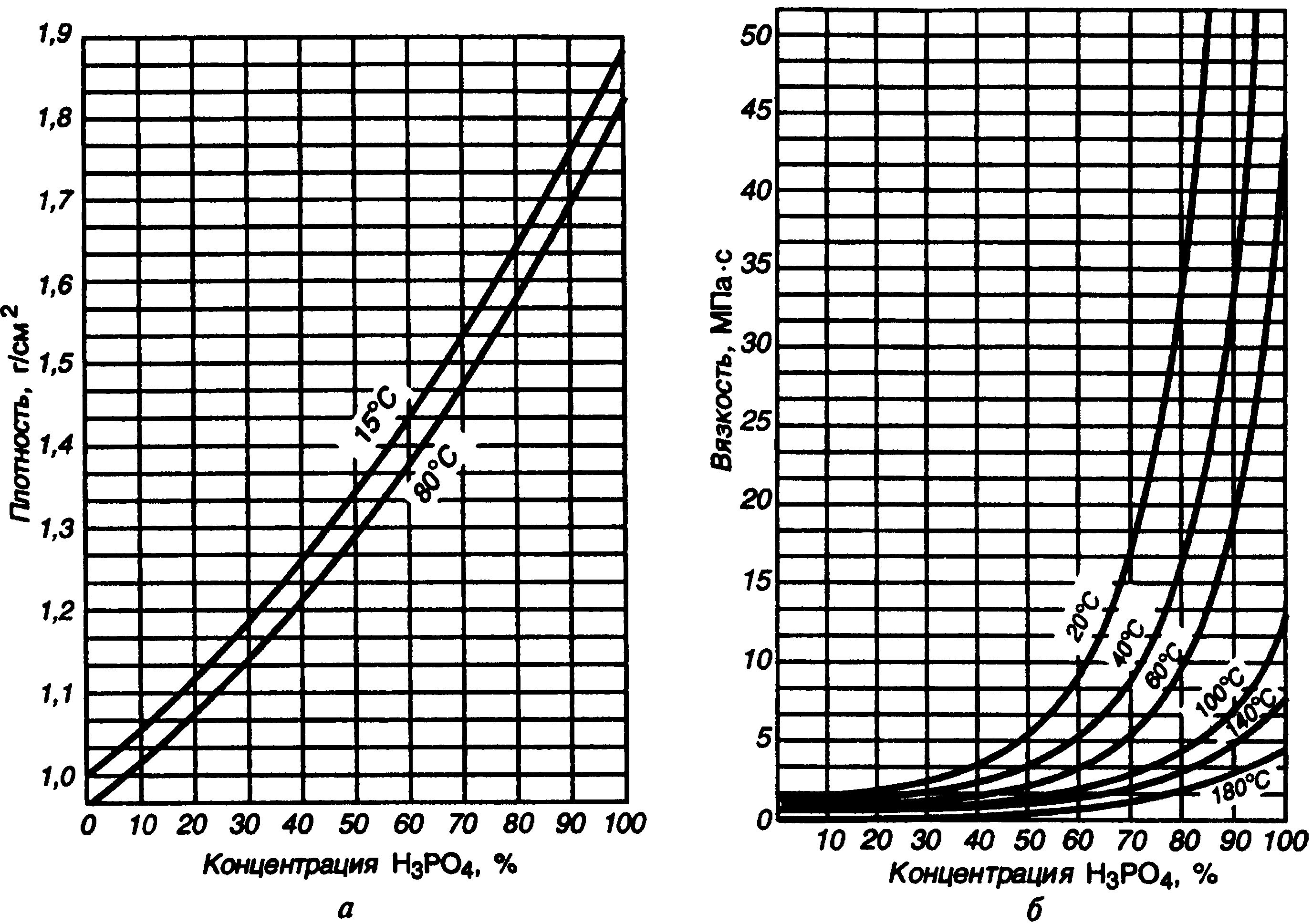
Рис.3 Кривые плотности (а) и вязкости (б) водных растворов фосфорной кислоты (при 20-180оС)

Рис.4Константа диссоциации фосфорной кислоты первой (а - Н3РО4 ↔ Н+ + Н2РО4-) и второй ступени (б - Н2РО4-↔ Н+ + НРО4-2)
На рис. 3а приведены кривые плотности Н3РО4 при 15 и 80° С, а на рис. 3б — данные по изменению вязкости растворов Н3РО4 при 20—180° С.
В химических реакциях фосфорная кислота диссоциирует в две ступени (рис. 4):
Н3РО4 ↔ Н+ + Н2Р04-, уравнение константы Ki диссоциации:
![]()
Н2Р04-↔Н+ + НР042-, уравнение константы диссоциации К2:
![]()
Фосфорная кислота при нормальных условиях малоактивна и реагирует только с карбонатами, гидроксидами и некоторыми металлами. При этом образуются одно-, двух- и трехзамещенные фосфаты. В процессе нагревания выше 80° С реагирует даже с неактивными оксидами, кремнеземом и силикатами. При повышенных температурах фосфорная кислота является слабым окислителем для металлов. В процессе действия на поверхность металлов раствором фосфорной кислоты, содержащей цинк или марганец, образуется защитная пленка. В процессе нагревания фосфорная кислота теряет воду с образованием пиро- и метафосфорных кислот по схемам:
2Н3РО4 = Н2О + Н4Р2О7 + 71,17 кДж,
Н4Р2О7 = Н2О + 2НРОз + 100,46 кДж/моль.
Применение фосфорной кислоты
Фосфорная кислота применяется в основном (около 85% производимого) для получения фосфорных и сложных удобрений, кормовых фосфатов, синтетических моющих и водоумягчающих средств. В металлообрабатывающей промышленности фосфорная кислота применяется в процессе фосфатирования поверхности металлов, а в текстильной — для обработки и крашения шерсти, натуральных и синтетических волокон. В технологии органических веществ фосфорную кислоту применяют в качестве катализатора. Фосфорную кислоту и ее производные применяют в процессе приготовления буровых суспензий при нефтедобыче, в производстве стекла, в фотографии (для приготовления светочувствительных эмульсий), в медицине (приготовление медикаментов, получение лекарственных средств, зубных цементов), в процессе обработки древесины (для придания огнестойкости). Производные фосфорной кислоты применяют также в пищевой промышленности (хлебопекарные порошки, приготовление плавленых сыров, в колбасном производстве и сахароварении).
