- •Соли h2so4 – сульфаты
- •Получение тиосульфатов
- •1) Окисление дисульфидов кислородом
- •2) Кипячение сульфитов с порошком серы
- •Применение тиосульфата натрия Na2s2o3
- •Пниктогены
- •История открытия
- •Распространение в земной коре
- •Основные характеристики пниктогенов и их соединений
- •Азот n2 строение молекулы n2
- •Физические свойства азота
- •Химические свойства азота
- •1) При обычной температуре взаимодействует только с литием
- •Получение азота
- •Применение азота
- •Аммиак nh3 История открытия аммиака
- •Строение молекулы nh3
- •Физические свойства аммиака
- •Химические свойства аммиака
- •Получение аммиака
- •2) Гидролизом нитридов
- •Применение аммиака
Окончание лекции № 9
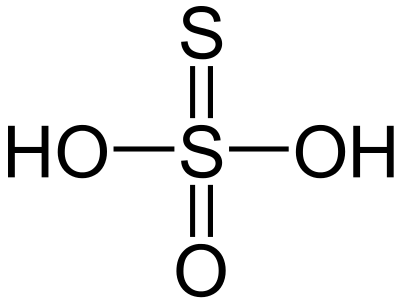
Соли h2so4 – сульфаты
Большинство сульфатов (кроме PbSO4, SrSO4, BaSO4, CaSO4) растворимы, бесцветны.
Из водных растворов выделяются в виде кристаллогидратов:
Na2SO4·10H2O – глауберова соль
CaSO4·2H2O – гипс
CuSO4·5H2O – медный купорос
Сульфаты щелочных и щелочно-земельных металлов термически устойчивы.
Сульфаты менее активных металлов при нагревании разлагаются:
ZnSO4 Combin ZnO + SO3
Ag2SO4 Combin Ag2O + SO2 + O2
Гидросульфаты при нагревании превращаются в пиросульфаты, отщепляя молекулу воды:
пиросульфат натрия |
Пиросульфаты при нагревании также разлагаются:
Na2S2O7 Combin Na2SO4 + SO3
ТИОСУЛЬФАТЫ
тиосульфат натрия |
Тиосерная кислота – бесцветная вязкая жидкость, не затвердевающая даже при очень низких температурах. Термически неустойчива. Быстро, но не мгновенно разлагается в воде.
Тиокислоты и тиосоли образуются при замещении атома кислорода на атом серы.
В молекуле тиосульфата степень окисления центрального атома серы – +4, бокового – 0.
Получение тиосульфатов
1) Окисление дисульфидов кислородом
Na2S2 + O2→ Na2S2O3
2) Кипячение сульфитов с порошком серы
Na2SO3 + S → Na2S2O3
Саму тиосерную кислоту выделить не удается, т.к. она неустойчива и в момент образования разлагается:
тиосерная кислота |
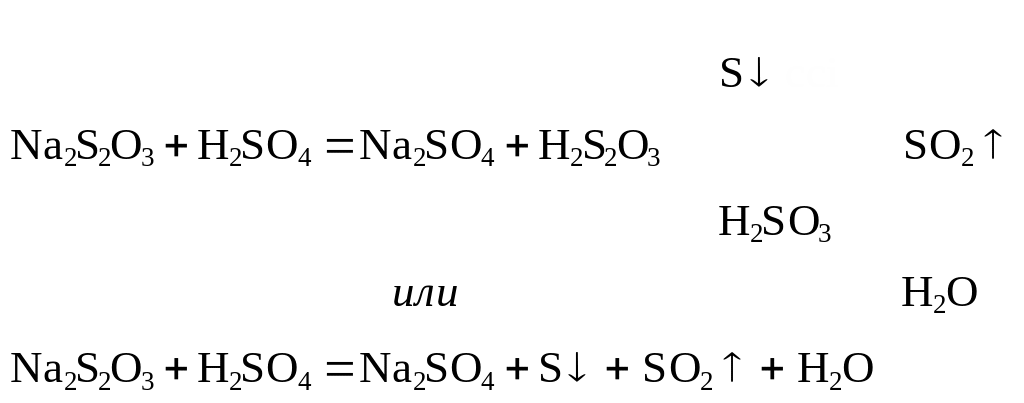
Тиосульфаты проявляют восстановительные свойства за счет дополнительного атома серы (=S0)
Na2S2O3 + Cl2 + H2O → Na2SO4 + HCl + S
Na2S2O3 + Cl2(изб.)+ H2O → NaHSO4 + HCl
Так удаляют излишки хлора при отбеливании тканей, поэтому тиосульфат натрия называют "Антихлор".
При действии более слабых окислителей образуются политионаты:
Na2S2O3
+ J2
→
![]() обесцвечивание
коричневой окраски раствора йода
обесцвечивание
коричневой окраски раствора йода
Применение тиосульфата натрия Na2s2o3
1. Фиксаж в фотографии;
2. В аналитической химии при йодометрическом титровании;
3. В горно-рудной промышленности для извлечения серебра и золота из руд и минералов;
4. В текстильной промышленности для удаления следов хлора после отбеливания и придания ткани прочности;
5. В пищевой промышленности как пищевая добавка Е539 (регулятор кислотности);
6. В медицине:
– как антидот при отравлениях ртутью, свинцом, мышьяком, цианидами, солями йода и брома,
– при детоксикации больных с алкогольными психозами;
– при лечении аллергических заболеваний, артрита и невралгии;
– при лечении кожных заболеваний (чесотка, псориаз).
Пниктогены
(гр. "пнигеин" – удушливый. По свойствам азота, который не поддерживает дыхание)
Элементы главной подгруппы V группы – N, P, As, Sb, Bi
История открытия
Азот (N) – "a zoos – неживой (гр.), nitrogenium – рождающий селитру (лат.)" – 1772 Г. Кавендиш (англ.) открыл азот, но никому не сообщил, кроме своего друга Дж. Пристли (англ.), поэтому первооткрывателем считается Д. Рутерфорд (англ.), который открыл азот независимо от Кавендиша в 1772 г.
Фосфор (P) – "несущий свет (гр.)" – 1669 Х. Бранд (англ.) получил перегонкой смеси мочи и глины.
1680 Р. Бойль получил аналогично. В 1772 году Шееле получил фосфор из костей.
Мышьяк (As) – "arsenik – мужское начало (гр.), мышиный яд (рус.)" – известен с II тыс. лет до н.э. в виде сплавов с медью. Неизвестно, когда получен металлический мышьяк.
Сурьма (Sb) – "stibi – грим, мазь (тюрк.), антимониум – против уединения (лат.)" – известна с III тыс. лет до н.э. В древности ее долгое время принимали за свинец.
Висмут (Bi) – "weisse materia – белая материя (нем.)" – известен с XV в. в Центральной Европе под разными названиями (демогоргон, глаура, нимфа, серое олово и т.д.). До XVIII в. висмут путали со свинцом, оловом и сурьмой. Лишь в XVIII в. Потт и Бергман предложили считать висмут простым веществом.