
- •Курсовая работа
- •Реферат
- •Содержание
- •Введение
- •1 Основная часть
- •Биоповреждения материалов и изделий и их вид
- •1.1.1 Виды бактериальных биоповреждений и их характеристика
- •1.1.2 Факторы, влияющие на биоповреждения объектов
- •1.1.3 Механизмы бактериальных биоповреждений
- •Характеристика микроорганизмов-декструкторов
- •1.2.1 Хемолитотрофные микроорганизмы (тионовые, нитрифицирующие, железобактерии)
- •1.2.2 Гетеротрофные бактерии (протеолитические, липолитические, гликолитические)
- •1.2.3 Метаногенные бактерии и их характеристика
- •1.3 Методы обнаружения бактерий и идентификации микроорганизмов
- •1.3.1 Методы обнаружения бактерий и определения их численности
- •1.3.2 Методы-выделения микроорганизмов-деструкторов
- •1.3.3 Методы определения активности микроорганизмов и продуктов их метаболизма
- •1.4 Способы защиты материалов и изделий от биоповреждений м/о
- •1.4.1 Использование защитных покрытий
- •1.4.2 Полимерные материалы с антимикробными свойствами
- •1.5 Методы оценки биостойкости материалов и защитных покрытий
- •1.5.1 Почвенный метод
- •1.5.2 Метод агаровых сеток
- •1.5.3 Метод агаровых блоков
- •1.5.4 Методы оценки адаптации бактерий к антимикробным веществам
- •2 Экспериментальная часть
- •2.1 Материалы и оборудование
- •2.2 Микроорганизмы и питательные среды
- •2.2.1Питательные среды для культивирования грибов
- •2.2.2 Выделение чистых культур бактерий
- •2.3 Методы анализа
- •2.3.1 Определение общего количества бактерий методом культивирования
- •2.3.2 Построение калибровочных зависимостей микроорганизмов по спектру мутности
- •2.3.3 Анализ физиологической активности бактерий редуктазным методом
- •2.3.4 Метод определения эффективных концентраций биоцидов
- •2.3.5 Оценка защитного действия биоцидных веществ методом «агаровой сетки» и «агаровых блоков»
- •2.3.6 Оценка защитного действия биоцидных веществ микрокалориметричеким методом
- •2.4 Результаты исследований и их обсуждение
- •2.4.1 Оценки биостойкости материалов по гост 9.048
- •2.4.2 Анализ биостойкости материалов по методу «агаровой сетки» и агаровых блоков
- •2.4.3 Характеристика биостойкости материалов микрокалориметрическим методом
- •Заключение
- •Используемая литература
2.3.4 Метод определения эффективных концентраций биоцидов
В
качестве метода определения эффективных
концентраций биоцида может быть
использован метод диффузии веществ в
питательном агаре. Для его реализации
на поверхность застывшего питательного
агара наносят по 0,1 см3
суспензии тест-культуры бактерий в
концентрации 107
кл./см3
и равномерно распределяют с помощью
стерильного шпателя по поверхности
агара. Затем укладывают стерильные
диски фильтровальной бумаги, пропитанные
в растворах биоцидов в диапазоне
концентраций 0,001–0,1 %. Чашки помещают в
термостат при температуре (30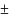 1)°С
на 24 часа. После инкубирования измеряют
диаметры зон задержки роста клеток
вокруг дисков.
1)°С
на 24 часа. После инкубирования измеряют
диаметры зон задержки роста клеток
вокруг дисков.
Ростовую активность бактерий в присутствии различных концентраций биоцидов оценивают по изменению оптической плотности D600 от времени. Для спектрофотометрического измерения оптической плотности к 9 см3 суточной культуры бактерий, содержащих 107 кл./см3, добавляют 1 см3 различных антисептиков. В качестве контрольных образцов служат клетки с добавками физиологического раствора вместо антисептиков. Через каждые 30 минут необходимо отбирать пробы и измерять оптическую плотность растворов при λ=600 нм в течение 8 ч.
Измерение тепловыделения микроорганизмов на поверхности исследуемых материалов выполняют на микрокалориметре МКМ-Ц. На образцы исследуемых материалов наносят чистые культуры бактерий Bacillus subtilis в питательном бульоне в концентрациях 104–108 кл./см2. Образцы обрабатывают антисептиком в концентрациях 0,1– 0,5 % или физиологический раствор. После загрузки проб в микрокалориметр регистрируют мощность тепловыделения поверхностной микрофлоры на протяжении 2–3 часов.
Оценка активности биоцидов, а также определение их эффективных концентраций, данным методом проводиться по диаметру зоны подавления роста микроорганизмов на поверхности питательного агара.
Анализ по данному методу позволяет установить, что, чем меньше концентрация веществ и выше диаметр зон отсутствия роста микроорганизмов, тем более активен препарат. О повышении резистентности клеток на поверхности материалов к применяемому антимикробному веществу можно судить по снижению диаметра зон подавления роста бактерий после посева смывов с поверхности на питательном агаре в присутствии дисков с той же рабочей концентрацией биоцида.
Достоинствами метода являются простота, наглядность, низкие затраты. К недостаткам способа следует отнести относительную длительность (сутки и более), невозможность анализировать полимерные антисептики.
Другим методом оценки активности антимикробных веществ и их эффективной концентрации в лабораторных условиях является спектрофотометрический способ. В данном случае биоцидную активность и эффективность препарата можно оценить по увеличению лаг-фазы задержки роста клеток и уменьшению количества жизнеспособных микроорганизмов по сравнению с контрольным образцом, регистрируемому по снижению величины (D/D0)600 от времени обработки.
Данный метод достаточно быстр и удобен, однако не всегда применим в случае слишком мутных сред и относительно низкого содержания микрооргпнизмов (ниже 106 кл./см3), а также не подходит для непосредственного анализа поверхностной микрофлоры [21].
