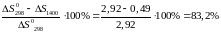Рішення
Ентропія
– одна з термодинамічих властивостей
індивідуальних речовин. Її значення
визначається природою речовини і
температурою. Тому зміна ентропії при
протіканні хімічної реакції також
уявляє собою конкретну для заданої
реакції і температури величину.
Розраховувати
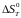 можна різними методами. Ми скори-стуємося
методом, заснованим на інтегруванні
рівняння
можна різними методами. Ми скори-стуємося
методом, заснованим на інтегруванні
рівняння
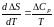 .
.
Якщо відома залежність теплоємності від температури і змінення ентропії реакції при 298 К, обчислюємо змінення ентропії реакції для будь-якої іншої температури по формулі:
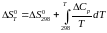 (1)
(1)
Але в реакції приймають участь різні речовини і для кожної з них залежно від наявності модіфікаційних і агрегатних перетворень, залежність ентропії від температури може виражатися різними рівняннями. При наявності в інтервалі 298 – Т,К фазових перетворень кількість доданків в правой частині рівняння (1) стає більше двох, оскільки весь інтервал температур від 298 до Т необхідно розбити на декілька більш коротких, у кожному з яких враховуються ті значення властивостей, які належать речовинам в цих інтервалах. Таким чином, при наявності одного перетворення, що відбувається з якоюсь речовиною в інтервалі температур 298-Т, рівняння набуває вигляду:
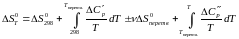
Оскільки
теплоємність
у
кожної
речовини залежить
від
температури
таким чином
 ,
то
,
то
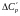 і
і
 знаходять
для
кожного
температурного
інтервала
з
урахуванням тих
значень
знаходять
для
кожного
температурного
інтервала
з
урахуванням тих
значень
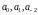 ,
які
кожна
з речовин має в
заданому
інтервалі:
,
які
кожна
з речовин має в
заданому
інтервалі:
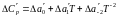
де
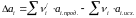
Подінтегральні
вирази
в
рівнянні
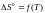 в загальному
випадку
обчислюються
таким чином::
в загальному
випадку
обчислюються
таким чином::
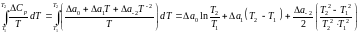
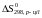 знаходимо
по закону
Гесса, як
різницю
абсолютних ентропій
утворення
речовин-продуктів
і
речовин, що вступають
до реакції.
знаходимо
по закону
Гесса, як
різницю
абсолютних ентропій
утворення
речовин-продуктів
і
речовин, що вступають
до реакції.
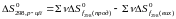
Значення
ентропії перетворення знаходимо так:
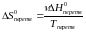
ПРИКЛАД. Розглянемо метод вирішення завдання на прикладі реакції:
C + O2 = CO2 Т=1400 К
Термодинамічні властивості речовин наведено в таблиці 1.
Із табличних даних видно, що всі речовини у вказаному інтервалі температур не змінюють свого агрегатного стану. Внаслідок цього розрахунок будемо вести в інтервалі 298…1400 K по формулі (1).
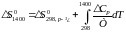 (1)
(1)
Розрахуємо
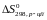 :
:
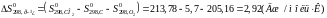
Таблиця 1 – Термодинамічні властивості речовин
Вещество |
Фаза |
|
|
|
|
|
||
|
|
|
||||||
С |
тв. |
- |
5,70 |
17,17 |
4,27 |
-8,79 |
- |
- |
CO2 |
газ |
393,78 |
213,78 |
44,14 |
9,04 |
-8,53 |
- |
- |
O2 |
газ |
- |
205,16 |
34,62 |
1,08 |
-7,86 |
- |
- |
Скориставшись відомостями про температурні коефіцієнти рівняння теплоємності, виконаємо чисельний розрахунок в інтервалі 298-1400К:
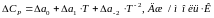
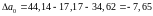

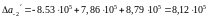
Таким чином, рівняння залежності теплоємності від температури набуває виду:

Подставимо
отримане рівняння
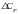 і значення
в рівняння (1) і обчислимо значення
і значення
в рівняння (1) і обчислимо значення
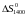 :
:

Проведені розрахунки показують, що при підвищенні температури з 298 до 1400 К величина ентропії реакції окислення вуглецю змінилась на 3,41 Дж/моль.К по абсолютній величині.
Знайдемо відносну зміну ентропії реакції (у %):