
- •Законы Фарадея
- •Равновесные явления в растворах электролитов
- •Неравновесные явления в растворах электролитов (электропроводность, диффузия)
- •Числа переноса ионов
- •Равновесные электродные процессы: эдс и электродные потенциалы
- •Термодинамика гальванического элемента
- •Формальная кинетика. Кинетика необратимых реакций
- •Методы определения порядка реакций
- •Зависимость скорости реакции от температуры
Равновесные электродные процессы: эдс и электродные потенциалы
1. Для следующих электрохимических цепей напишите уравнения реакций, протекающих на отрицательном и положительном полюсах гальванического элемента, а также уравнение суммарной реакции. Предварительно проверьте, правильно ли записаны приведенные цепи.
а) CuZnZnSO4CuSO4Cu ;
б) CuCuCl2AgClAgCu ;
в) PtCdCdSO4Hg2SO4HgPt ;
г) PtH2H2SO4Hg2SO4HgPt ;
д) CuCu(OH)2NaOHH2PtCu ;
е) AgAgClHClHg2Cl2HgAg .
2. Приведите схематическую запись электрохимических цепей, в которых протекают следующие электрохимические реакции:
а) Cd + CuSO4 = CdSO4 + Cu ;
б) Zn + 2Fe3+ = Zn2+ + 2Fe2+ ;
в) 2Ag+ + H2 = 2Ag + 2H+ ;
г) Ag+ + J– = AgJ (тв);
д) Ag + ½ J2 = AgJ (тв);
е) H2 + Cl2 = 2HСl ;
ж) H+ + OH– = H2O ;
з) H2 + ½ O2 = H2O ;
и) 2Ме + О2 + mH2O = 4OH– + 2Me2+mH2O ;
к) O2 + 2Fe + 2H2O = 2Fe(OH)2 ;
л) Cl2 + Mg = MgCl2 ;
м) Cl2 + Mg = 2Cl– + Mg2+ ;
н) Li + ½ F2 = LiF .
Может ли последняя реакция протекать в водном растворе?
3. Пользуясь справочными данными, определите направление реакции, протекающей в водном растворе при 298 К, и рассчитайте ее константу равновесия:
Ag + Fe3+ Fe2+ + Ag+ .
(Кравн = 2,98)
4. Пользуясь справочными данными о величинах стандартных электродных потенциалов, рассчитайте при 298 К константы равновесия реакций:
а) Pu3+ + 3Li = Pu + 3Li+ ; б) Fe2+ + S2– = Fe + S .
(а) Кравн = 10258 ; б) Кравн = 1,726)
5. Пользуясь справочными данными, напишите выражение для ЭДС элемента
MnMnCl2Cl2Pt
и уравнения протекающих в нем реакций. Определите, можно ли за счет изменений концентраций ионов или давления газа изменить знак ЭДС (заставить реакцию пойти в противоположном направлении).
6. Вычислите
активность ионов Hg2+
в растворе, при которой потенциал
электрода Hg2+Hg
по отношению к с.в.э. равен нулю (Т= 298
К). Может ли практически ртуть в растворе
соли Hg2+
приобрести отрицательный потенциал?
(![]() =
1,12510–29
моль/л)
=
1,12510–29
моль/л)
7. Вычислите
стандартный потенциал цинкового
электрода 1-го рода по отношению к
стандартному водородному и одномолярному
каломельному электродам при Т = 298 К,
если в 0,005 М ZnCl2
электродный потенциал равен –0,834 В по
с.в.э. (![]() (с.в.э.)
= –0,763 В;
(кал.
1 М) = –1,044 В)
(с.в.э.)
= –0,763 В;
(кал.
1 М) = –1,044 В)
8. Рассчитайте потенциал каломельного электрода в растворе 0,005 М CuCl2 при 293,2 К, если средний коэффициент активности для этого раствора равен 0,783. Зависимость стандартного потенциала каломельного электрода от температуры выражается уравнением:
Еокал, Т = Еокал, 298,2 – 0,317·10–3 (Т – 298,2) – 2,832·10–6 (Т – 298,2)2 .
(Екал = 0,3921 В)
9. С помощью первого
приближения теории Дебая – Гюккеля
оцените потенциал водородного электрода
при давлении водорода 1,282 атм (летучесть
считать равной давлению) и концентрации
HCl
0,005 М; t
= 25оС.
(![]() =
–0,141 В)
=
–0,141 В)
10. Значение
потенциала никелевого электрода при
298,2 К в растворе Ni(NO3)2
относительно одномолярного каломельного
электрода равно –0,563 В. Определить
активность ионов никеля в растворе.
Диффузионный потенциал устранен. (![]() =
8,35610–2
моль/л)
=
8,35610–2
моль/л)
11. Потенциал сурьмяного металлоксидного электрода (относительно с.в.э.) в исследуемом растворе составил +0,472 В. Пользуясь справочными данными, рассчитайте значение рН раствора. Т = 298,2 К. (рН = 8,57)
12. Измеренное значение потенциала оксиднортутного электрода в исследуемом растворе по отношению к децимолярному каломельному электроду составило 0,062 В при 298,2 К. Рассчитайте величину рН исследуемого раствора, пользуясь справочными данными. Диффузионный потенциал устранен. (рН = 8,94)
13. Какой потенциал имеет хингидронный электрод в растворе с рН = 3,0 относительно стандартного каломельного электрода? Т = 298,2 К. (Е = 0,254 В)
14. Вычислить при 298,2 К потенциал электрода КCl (0,005 М) Cl2 Pt против каломельного электрода сравнения в том же растворе. Парциальную упругость хлора принять равной 1,0133105 Па, значения стандартных электродных потенциалов взять из справочника. (Е = 1,092 В)
15. Рассчитайте стандартный электродный потенциал полуэлемента
KJAgJAg
по данным о
произведении растворимости AgJ
и стандартном электродном потенциале
системы Ag+Ag.
(![]() =
–0,150 В)
=
–0,150 В)
16. Вычислить при 298К ЭДС элемента, используя справочные данные о ПР малорастворимых соединений:
Ag g2S (нас. р-р) gCN (нас. р-р) Ag .
(Е = 0,558 В)
17. Рассчитайте произведение растворимости CuJ в воде при 25оС по данным о стандартных электродных потенциалах. (ПР = 1,0810–12 (моль/л)2 )
18. Пользуясь справочными данными о величинах стандартных электродных потенциалов, рассчитайте растворимость Ag2SO4 в воде при 25оС.
(S =0,0145 моль/л)
19. Растворимость CdCO3 в воде при 25оС равна 1,5810–7 моль/л. Рассчитайте стандартный потенциал полуэлемента
CO32–CdCO3Cd ,
если стандартный
потенциал кадмиевого электрода 1-го
рода равен –0,403 В. Сравните рассчитанную
величину со справочной. (![]() =
–0,804 В)
=
–0,804 В)
20. Рассчитайте значение ЭДС элемента Со Со(OH)2 KOH HgO Hg при Т= 298,2 К. Произведение растворимости Со(OH)2 при этой температуре составляет 4,7·10–16. Стандартный потенциал кобальтового электрода 1-го рода составляет –0,277 В, стандартный потенциал окиснортутного электрода равен 0,098 В; другими справочными данными не пользоваться. (Е = 0,827 В)
21. ЭДС элемента
Pb
PbJ2
KJ
Pb(NO3)2
Pb
равна 0,055 В при 298,2 К. Электроды опущены
в растворы солей концентрации 0,01 М.
Средний коэффициент активности раствора
KJ
равен 0,903, а раствора Pb(NO3)2
– 0,690. Рассчитать ПР иодида свинца,
считая, что элемент работает обратимо.
Другими справочными данными не
пользоваться. (![]() =
7,9110–9
)
=
7,9110–9
)
22. ЭДС элемента
PtHgHg2Cl2KCl (m = 0,1)FeCl2 (m = 0,01), FeCl3 (m = 0,01)Pt
при 298 К равна 0,446
В. Принимая коэффициенты активности
ионов Fe2+
и Fe3+
равными 0,75 и 0,87 соответственно, рассчитайте
величину стандартного электродного
потенциала ферроферритного электрода.
(![]() =
0,776 В)
=
0,776 В)
23. ЭДС элемента
CdCdJ2AgJAg
равна 0,286 В при 298
К. Пользуясь справочными данными о
величинах стандартных электродных
потенциалов, определите общую активность
иодида кадмия в растворе. (![]() =
0,065)
=
0,065)
24. Для элемента
ZnZnSO4 (m1 = 0,005)ZnSO4 (m2 = 0,05)Zn
при 298 К ЭДС равна 0,0185 В. Вычислите в концентрированном растворе, если в разбавленном растворе = 0,477. ( = 0,202)
25. Определите рН соляной кислоты, если для элемента
PtHgHg2Cl2KCl (0,1 M)хингидрон (нас.), HCl (c = 0,1 M)Pt
при 298 К ЭДС равна 0,301 В. (рН = 1,09)
26. Определите ЭДС элементов при 298 К, пользуясь справочными данными:
а) PtH2 (p = 2 атм)H+ (a1 = 0,1)хингидрон (нас.), H+ (a2 = 2)Pt ;
б) PtHgHg2Cl2KCl (1,0 M)хингидрон (нас.), CH3COOH (c = 0,1 M)Pt .
(а) Е = 0,785 В; б) Е = 0,2484 В)
27. Стандартная ЭДС элемента
PtH2
(![]() )HCl
(m,
)Hg2Cl2HgPt
)HCl
(m,
)Hg2Cl2HgPt
при 298 К равна 0,2680 В. Вычислите ЭДС при следующих условиях: 1) = 0,01 атм, m = 1, = 0,809; 2) = 0,1 атм, m = 0,001, = 0,966. (1) Е = 0,220 В; 2) Е = 0,594 В)
28. Вычислите ЭДС элемента при 298 К, пользуясь справочными данными:
PtH2NH4OH (с = 0,01 М)CH3COOH (c = 0,1 M)H2Pt
( = 1 атм для обоих электродов). (Е = 0,457 В)
29. С помощью первого приближения теории Дебая – Гюккеля рассчитайте ЭДС элемента при 25оС:
Cd Cd(NO3)2 (0,005 моль/л) KCl (0,02 моль/л) AgCl Ag .
Воспользуйтесь справочными данными о величинах стандартных электродных потенциалов. (Е = 0,801 В)
30. Опытное значение ЭДС элемента, состоящего из каломельного электрода и водородного электрода в 0,05 М HCl в качестве электролита, равно 0,422 В при давлении водорода 5,8104 Па. Коэффициент активности кислоты такой концентрации равен 0,830. Вычислить стандартную ЭДС этого элемента при 298 К.
(Ео = 0,266 В)
31. Вычислите при
298 К стандартный электродный потенциал
полуэлемента Tl3+Tl,
если стандартные электродные потенциалы
для электродов Tl+
, Tl3+Pt
и Tl+Tl
равны +1,25 В и –0,336 В соответственно.
(![]() =
+0,721 В)
=
+0,721 В)
32. Вычислите при
298 К стандартный электродный потенциал
полуэлемента Cu+Cu,
если известны стандартный электродный
потенциал электрода Cu2+Cu
и константа равновесия реакции Cu
+ Cu2+
2Cu+
Ка
= 6,3110–7
. (![]() =
+0,520 В)
=
+0,520 В)
33. Гальванический элемент
HgHg2Cl2KCl (1 M)Mn2+ (а = 0,01) , MnO4– (а = 0,1) , H+Pt
использован для определения рН раствора. ЭДС этого элемента при 298 К равна 1,07 В. Пользуясь справочными данными, определите рН раствора.
(рН = 1,81)
34. ЭДС элемента
ZnZnSO4 (m1 = 0,01)ZnSO4 (m2 = 0,1)Zn
при 298 К равна 0,0235 В. Можно ли в данном случае пренебречь диффузионным потенциалом? Сравните вычисленную ЭДС с приведенной и сделайте соответствующий вывод. (Евычисл = 0,017 В; нельзя пренебречь)
35. Под каким давлением находится водород в левом полуэлементе, если ЭДС элемента
PtH2 (p = ?)HClH2 (p = 1,0133105 Па)Pt
при 298 К составляет 0,0059 В? ( = 1,585 атм = 1,606105 Па)
36. Вычислите ЭДС элемента при 298 К:
PtZn (Hg) (a1 = 0,00337)ZnSO4Zn (Hg) (a1 = 0,00011)Pt .
(Е = 0,044 В)
37. Вычислить ЭДС концентрационного элемента, составленного из двух амальгамных натриевых электродов с одинаковой активностью амальгамы натрия, погруженных в 0,1 М и 0,01 М растворы NaСl соответственно. Число переноса Cl– равно 0,604. Средний коэффициент активности 0,1 М раствора принять равным 0,778, а для раствора концентрации 0,01 М считать справедливым второе приближение теории Дебая – Гюккеля. Т = 298,2 К. (Е = 0,0668 В)
38. Вычислить ЭДС концентрационного элемента, включающего два таллиевых электрода в 0,1 М и 0,001 М TlClO4 . Средний коэффициент активности 0,1 М раствора равен 0,730, а для раствора 0,001 М справедлив предельный закон Дебая – Гюккеля. Подвижности ионов таллия и перхлората равны 74,7 и 67,3 см2/(Омг-экв) соответственно. Т = 298,2 К. (Е = 0,105 В)
39. Вычислить активность натрия в амальгаме, если потенциал электрода
NaCl (0,5 M) a, Hg
при 298,2 К по хлорсеребряному электроду сравнения в том же растворе равен –1,912 В. Стандартный потенциал амальгамы натрия (по с.в.э.) равен –1,739 В. Средний коэффициент активности раствора NaCl принять 0,681.
(aNa(Hg) = 1,72610–2 моль/л)
40. Пользуясь справочными данными, вычислите стандартный потенциал амальгамного таллиевого электрода, если при 298 К ЭДС цепи
PtTl (Hg) (aTl = 0,0628)TlClO4 (m = 0,1)KCl (0,1 M)Hg2Cl2HgPt
равна
0,610 В.
(![]() =
– 0,28 В)
=
– 0,28 В)
41. Для элемента
PtPb (Hg) (NPb = 0,0192)PbSO4H2SO4 (m = 0,02)H2 ( = 1 атм)Pt
при 298 К ЭДС равна
0,1238 В. Стандартный потенциал амальгамного
электрода
![]() =
–0,353 В. Вычислите активность и коэффициент
активности свинца в амальгаме. (аPb(Hg)
= 0,0229;
= 0,234)
=
–0,353 В. Вычислите активность и коэффициент
активности свинца в амальгаме. (аPb(Hg)
= 0,0229;
= 0,234)
42. ЭДС гальванического элемента
PtH2 ( = 1 атм)HCl (m = 0,01)Cl2Pt
зависит от давления Cl2 :
-
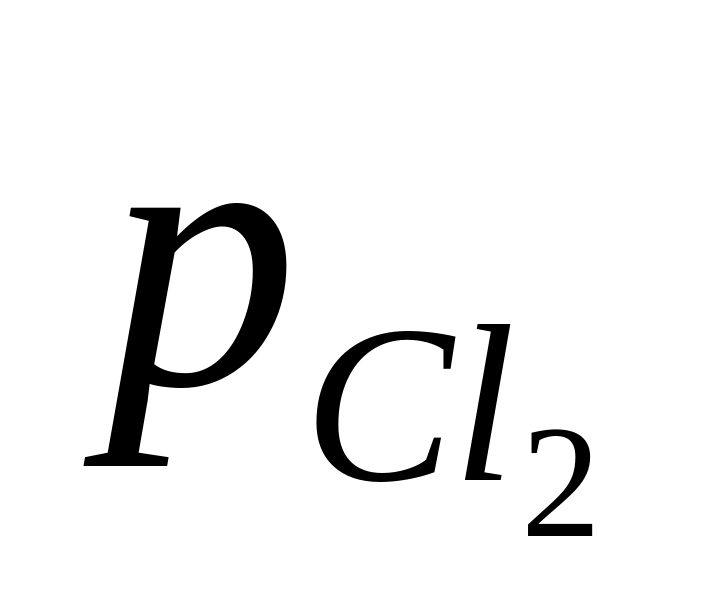 ,
атм
,
атм1
50
100
Е, В
1,5962
1,6419
1,6451
Определите фугитивность Cl2 и коэффициент фугитивности при 50 и 100 атм.
(50 атм:
![]() =
35,5 атм,
= 0,71; 100 атм:
=
45,46 атм,
= 0,4546)
=
35,5 атм,
= 0,71; 100 атм:
=
45,46 атм,
= 0,4546)
43. Вычислите ЭДС элемента
K, HgKCl (0,05 m)AgClAgAgClKCl (0,2 m)K, Hg
при 298 К, если обе амальгамы имеют одинаковую активность атомов калия.
(Е = 0,064 В)
44. Чему равна ЭДС элемента
AgAgClKCl (0,5 M)K, HgKCl (0,01 M)AgClAg
при 298 К? (Е = 0,184 В)
45. Средний коэффициент активности NaCl в 0,1 М растворе при 298 К равен 0,786. Вычислите средний коэффициент активности NaCl в 3 М растворе, если ЭДС цепи
AgAgClNaCl (3 M)Na, Hg NaCl (0,1 M)AgClAg
равна 0,1707 В при 298 К. ( = 0,732)
46. Как изменится стандартная ЭДС элемента ZnZn2+Cu2+Cu (Т = 298 К), если цинковый и медный электроды находятся в растворах своих роданидных комплексных солей, содержащих ионы Cu(SCN)3– и ZnSCN+ с константами нестойкости 7,8310–13 и 2,410–2 соответственно? (Ео = 1,1 В и 0,791 В)
47. Рассчитайте константы нестойкости комплексных соединений кадмия при 298,2 К, если стандартные потенциалы кадмия в растворах, содержащих Cd2+ ; Cd(CN)42– ; Cd(NH3)42+ равны –0,403; –1,09; –0,61 В соответственно. (Кнест = 5,1310–24 и 9,610–8 )
48. Вычислите константу нестойкости комплекса PdCl42– при 298 К, если стандартные потенциалы электродов Pd2+Pd и PdCl42–Pd соответственно равны 0,987 В и 0,623 В. (Кнест = 4,5710–13 )
49. При погружении
железа в раствор, содержащий Bi3+
, происходит
реакция контактного обмена, вызванная
тем, что стандартные потенциалы электродов
Fe2+Fe
и Bi3+
Bi
соответственно равны –0,4402 и +0,2150 В.
Рассчитайте равновесное соотношение
активностей ионов Fe2+
и Bi3+
в такой электрохимической системе для
стандартных условий. Выясните, возможна
ли реакция цементации при погружении
железа в раствор комплексной соли
висмута, содержащей ионы BiBr63–
с константой нестойкости 210–10
. (![]() =
1066,6 ;
=
1066,6 ;
![]() =
1047,2,
возможна)
=
1047,2,
возможна)
