
- •Лекция 1
- •Часть 1. Металловедение и термическая обработка металлов.
- •2. Классификация материалов и требования к ним.
- •3. Металлы и их свойства. Металлическая связь.
- •4. Кристаллическое строение металлов. Типы кристаллических решеток.
- •5Анизотропия свойств кристаллов.
- •Лекция 2 процессы плавлЕнИя и кристаллизации металлов
- •2. Процесс зарождения и роста кристаллов.
- •3. Строение слитков.
- •4. Скорость процесса кристаллизации.
- •5. Величина зерна.
- •Методы исследования кристаллического строения металла.
- •7Диффузия.
- •Лекция 3 превращения металлов в твердом состоянии. Металлические сплавы.
- •2. Магнитные превращения.
- •3. Основные понятия о сплавах.
- •Механические смеси.
- •Химические соединения в сплавах.
- •Лекция 4 диаграммы состояния
- •2.Принцип построения диаграммы состояния.
- •Диаграмма состояния для сплавов, образующих механические смеси. Ι тип диаграммы состояния.
- •4.Анализ диаграмм состояния двойных сплавов. Правило фаз. Правило отрезков.
- •5. Диаграма состояния п типа (с неограниченной растворимостью в твердом состоянии).
- •6. Диаграмма состояния ш типа.
- •7.Связь между свойствами сплава и типом диаграммы состояния. Правило Курнакова.
5Анизотропия свойств кристаллов.
Анизотропия – это векториальность, неодинаковость свойств кристалла в разных кристаллографических направлениях, возникающая в результате упорядоченного расположения атомов (ионов) в пространстве. Различны расстояния между атомами в разных кристаллографических направлениях, различны и свойства, т.к. последние определяются взаимодействием атомов. Наиболее сильно анизотропия проявляется в кристаллах со структурами, обладающими малой симметрией. Анизотропия присуща всем свойствам кристаллов и особенно важна при использовании монокристаллов (т.е. кристаллов, полученных искусственным путем). В природных условиях кристаллические тела, как уже отмечалось, поликристалличны и состоят из множества мелких, различно ориентированных кристаллов. В этом случае анизотропия не проявляется, т.к. среднестатистическое расстояние между атомами по всем направлениям примерно одинаково. В связи с этим поликристаллические тела считают мнимоизотропными.
При обработке поликристаллов давлением кристаллографические плоскости одного индекса (индексы направления – это координаты узла кристаллической решетки, выраженные целыми числами u, υ, ω, в единицах отрезков а, в, с) в различных зернах могут ориентироваться параллельно. Такие поликристаллы называют текстурованными и они подобно монокристаллам, анизотропны. У аморфных тел свойства не зависят о направления.
Лекция 2 процессы плавлЕнИя и кристаллизации металлов
Понятие о процессах плавления и кристаллизации. Условие кристаллизации. Термические кривые.
1.Процессы зарождения и роста кристаллов.
2. Строение слитков.
3. Скорость процесса кристаллизации.
4. Величина зерна. Модифицирование.
5. Методы исследования кристаллического строения металлов.
6. Диффузия.
Кристаллизацией называют переход металла из жидкого состояния в твердое (кристаллическое). Известно, что все вещества могут находиться в твердом, жидком, газообразном состояниях. При определенных температурах происходит изменение агрегатного состояния чистых металлов. При нагреве выше температуры плавления (Тпл). Твердое состояние сменяется жидким, а при нагреве выше температуры кипения (Тк) жидкое состояние сменяется газообразным.
Главным признаком твердого состояния является кристаллическое строение. Жидкий расплав характеризуется хаотическим тепловым движением атомов и молекул металла.
Процесс плавления металла заключается в разрушении кристаллического строения при достижении Тпл.
Затрачиваемая на разрушение кристаллических решеток энергия является для каждого металла величиной постоянной и характеризуется теплотой плавления.
Тпл для различных металлов находится в пределах от –38,9 (Hg) до +3410 °С (W).
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с меньшей свободной энергией Z, т.е. когда Zкр < Zж.
Свободная энергия определяется Z=U-TS, где
U – полная внутренняя энергия системы
T – абсолютная температура
S – энтропия
Свободной энергией (термодинамическим потенциалом) называют ту составляющую полной энергии вещества, которая обратимо изменяет свою величину с изменением температуры. С повышением температуры Z уменьшается.
Изменение свободной энергии Z жидкого и твердого состояния в зависимости от температуры показано на рисунке:
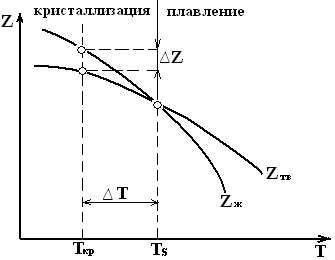
Выше Ts более устойчив жидкий металл, имеющий меньший запас свободной энергии, ниже Ts – устойчив твердый металл. При Ts Zж=Zтв. При этой температуре жидкая и твердая фазы могут существовать бесконечно долго. Отклонение в ту или иную сторону является термодинамическим стимулом для плавления или кристаллизации.
Процесс кристаллизации развивается, когда созданы условия для возникновения разности свободных энергий, образующейся вследствие меньшей свободной энергии твердого металла по сравнению и жидким.
Таким образом, процесс кристаллизации может протекать только при переохлаждении металла ниже равновесной температуры Ts
Разность между Ts и Ткр, ∆ Т=Ts – Ткр называется степенью переохлаждения.
Изобразим термические кривые, характеризующие процесс кристаллизации металла при разных скоростях охлаждения:
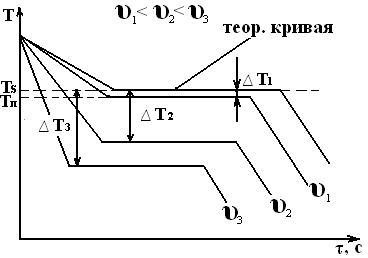
При очень медленном охлаждении ∆Т невелика и кристаллизация протекает при температуре, близкой к равновесной. С увеличением υохл ∆Т возрастает. Для полного переохлаждения металла в жидком состоянии требуются большие скорости охлаждения (миллионы и даже миллиарды °/с). Охлаждение жидкого металла до комнатной температуры следует проводить так, чтобы получить переохлажденный жидкий металл (т.е. не имеющий кристаллического строения) за ничтожную долю секунд. Такой металл называется аморфным или металлическим стеклом. Начинает применяться на практике. Степень переохлаждения зависит от природы и чистоты металла. Чем чище металл, тем более склонен он к переохлаждению, например, при затвердевании Sn была достигнута ∆Т=1180С, но скачок указывает на то, что в результате переохлаждения образуется большое число центров кристаллизации, рост кристаллов происходит так бурно, что температура скачкообразно повышается, чаще степень переохлаждения не более 10-30оС.
Скачок на кривой охлаждения указывает на то, что в результате большего переохлаждения образуется большее число центров кристаллизации, рост кристаллов происходит так бурно, что температура скачкообразно повышается почти до температуры плавления. Это характерно для Sb, температура переохлаждения 631 – 590 = 41 °С.
На перевод жидкого металла в газообразное состояние также затрачивается энергия, характеризующаяся температурой кипения (Ткип).
