
Уравнение состояния идеального газа
Из закона Авогадро следует, что массы равных объемов двух газов относятся друг к другу как их молярные массы: D = m1/m2 = M1/M2. Эта величина называется относительной плотностью первого газа по второму.
Объединенное уравнение, описывающее состояние идеального газа, носит название УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА (уравнение Менделеева - Клайперона):
PV = nRT или PV = m/M*RT,
где Р – давление, при котором находится данное количество, Па; V – объем газа, м3: n – число молей газа; Т – абсолютная температура, Кельвин; R – универсальная газовая постоянная, характеризует работу расширения 1 моль идеального газа при нагревании его на 1 градус, R = P0V0/T0 = 8,314 Дж/моль*К.
Универсальная постоянная связана с константой Больцмана соотношением: k = R/Na = 13,805.10-24 Дж/К, где Na – постоянная Авогадро.
Если необходимо произвести расчет параметров газа, находящегося в смеси с другими газами, то пользуются парциальным давлением данного газа. ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ газа – это давление, которое оказывал бы данный газ, если бы занимал весь объем. Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений этих газов.
Примеры решения задач
1. ПРИВЕДЕНИЕ ОБЪЕМА ГАЗА К НОРМАЛЬНЫМ УСЛОВИЯМ (н.у.)
Какой объем при н.у. займут 0,4.10-3 м3 газа, находящегося при 500 С и давлении 9,54.104 Па?
РЕШЕНИЕ. Для приведения объема газа к н.у. воспользуемся уравнением, объединяющим законы Бойля – Мариотта и Гей – Люссака: PV/T = P0V0/T0, откуда V0 = PVT0/P0T, где T0 = 273 К;
P0 = 1,013.105 Па. T = 273 + 50 = 323 K, т.о.
V0 = 9,54.104 *0,4.10-3 * 273/323 * 1,013*105 = 0,32.10-3 м3.
2. ВЫЧИСЛЕНИЕ МОЛЯРНОЙ МАССЫ ГАЗА ПО ЗАДАННОМУ ОБЪЕМУ
Вычислить молярную массу газа, если 0,327.10-3 м3 его при давлении 1,04.105 Па и температуре 130С имеют массу 1,01 г.
РЕШЕНИЕ. Из уравнения следует, что M = mRT/PV = 1,01*8,31*(273+13)/1,04*105*0,327*10-3 = 70,9 = г/моль.
3. ОПРЕДЕЛЕНИЕ ПАРЦИАЛЬНОГО ДАВЛЕНИЯ ГАЗА ПРИ СМЕШЕНИИ.
Смешивают 3 л СО2 с 4 л О2 и 6 N2. До смешения давления газов составляли соответственно 96,108 и 90,6 кПа. Общий объем смеси 10 л. Определить парциальное давление газов и общее давление смеси.
РЕШЕНИЕ. Определим парциальные давления газов:
PCO2 = 96*3/10 = 28,8 кПа,
PO2 = 108*4/10 = 43,2 кПа,
PN2 = 90,6*6/10 = 54,4 кПа.
Общее давление газовой смеси равно сумме парциальных давлений ее компонентов Робщ = 28,8 + 43,2 + 54,4 = 126,4 кПа.
4. РАСЧЕТ АБСОЛЮТНОЙ МАССЫ МОЛЕКУЛЫ ВЕЩЕСТВА.
Рассчитайте массу молекулы газа (mM), если масса 1 л газа при н.у. равна 1,785 г.
РЕШЕНИЕ. Масса одной молекулы газа может быть определена как частное от деления его молярной массы на постоянную Авогадро: mM = M/Na, в тоже время число молекул газа равно отношению его объема к молярному объему или отношению массы газа к его молярной массе:
n = V/VM = m/M, отсюда M = VM*m/V = 22,4 * 1,785/1 = 39,984 г/моль.
mM = M/Na = 39,984/6,02.1023 = 6,64.10-23 г.
5. ОПРЕДЕЛЕНИЕ АТОМНОЙ МАССЫ МЕТАЛЛА ПО ЕГО ЭКВИВАЛЕНТУ
При нагревании 0,542 г оксида метала (II) получили 28 мл кислорода (н.у.). Вычислить атомную массу металла.
РЕШЕНИЕ. Согласно закону эквивалентов
mMeO / ЭМеО = VO2 / ЭV (1)
Эквивалентный объем кислорода равен 1/4 его молярного объема: ЭV = 0,25*VM = 0,25 * 22,4 = 5,6 л/моль, а ЭMeO = ЭMe + ЭО2. (2) В тоже время ЭО2 = МО2 * 1/4 = 32* 1/4 = 8 г/моль. Из соотношений (1) и (2) получим
Эмет = ЭV * mMeO – ЭO2 * VO2/VO2 = 5,6 * 0,542 – 8 * 0,028/0,028 = 100,3 г/моль.
Отсюда Ммет = Эмет * В = 100,3 * 2 = 200,6 г/моль. Это ртуть.
ЗАДАНИЕ 1
Сколько молекул содержится в 1 л любого газа при н.у.?
Взяты равные массы О2 и Н2 при одинаковых условиях. Найти соотношение объемов взятых газов.
При 170 С газ занимает объем 580 мл. Какой объем будет занимать этот газ при 1000 С, если Р = const?
При сгорании 5 г металла образуется 9,44 г оксида этого металла. Определить эквивалентную массу металла.
Эквивалентная масса металла 25,47 г/моль. Определить, сколько процентов кислорода содержится в оксиде этого металла.
ЗАДАНИЕ 2
Определить, сколько молекул содержится: а) в 10 л водорода при н.у.; б) в 10 г водорода?
Сколько молей вещества содержится в 1м3 любого газа при н.у.?
2,5 л газа находится под давлением 121,6 кПа. Каково будет давление газа, если сжать его до объема 1 л при Т = const?
Одно и тоже количество металла соединяется с 0,2 г О2 и с 3,17 г одного из галогенов. Определить эквивалентную массу галогена.
Эквивалентная масса Fe в его оксиде 18,6 г/моль. Какой объем водорода идет на восстановление 16 г оксида при н.у.
ЗАДАНИЕ 3
Определить число молекул, содержащихся в 1 г NH3 и 1 г О2?
Сколько киломолей вещества содержится: а) в 0,1 м3 водорода при н.у.; б) в 0,1 кг водорода?
На сколько градусов надо нагреть газ, находящийся в закрытом состоянии при 00 С, чтобы его давление увеличилось вдвое?
Вычислить атомную массу двухвалентного металла и определить металл, если 8,34 г его окисляется 0,68 л кислорода при н.у.
При восстановлении 16 г оксида металла (III) алюминием было получено 10,2 г Al2O3. Определить эквивалентную массу металла, если эквивалентная масса алюминия 9 г/моль.
ЗАДАНИЕ 4
Выразить в килограммах массу одной молекулы SO2.
Сколько молей вещества содержится в 100 г воды?
Объем автомобильной камеры 25 л, давление 506 кПа. Определить массу находящегося в камере воздуха при 200С.
1 г металла соединяется с 8,89 г брома, либо с 1,78 г серы. Каковы эквивалентные массы брома и металла, если эквивалентная масса серы 16 г/моль?
При восстановлении 33,5 г оксида металла (II) водородом образовалось 2,7 г воды. Определить эквивалентную и атомную массы металла.
ЗАДАНИЕ 5
Какой объем при н.у. занимают 0,12.1024 молекул газа?
Какое количество молей вещества содержится: а) в 10 л водорода и аммиака при н.у.; б) в 10 г водорода и аммиака?
Рассчитать молярную массу газа, если 7.10-3 кг его при давлении 253 кПа и 200 С занимают объем 22,18.10-3 м3.
На восстановление 1,8 г оксида металла требуется 833 мл водорода (н.у.). Определить эквивалентные массы металла и оксида.
Оксид металла (III) содержит 30% кислорода. Рассчитать атомную и эквивалентную массу металла.
ЗАДАНИЕ 6
Сколько молекул содержится в 100 мл воды при 200С?
Какое количество молей вещества содержится: а) в 100 мл водорода при н.у.; б) в 100 г NaCl?
Давление воздуха в автомобильной шине 304 кПа при 150 С. Как изменится давление в шине при ее нагреве до 600 С? Объем считать постоянным.
При нагревании 20,06 г металла получили 21,66 г оксида. Определить эквивалентную массу металла.
При взаимодействии металла (II) c 3,2 г серы, образовалось 8,76 г сульфита металла. Какова атомная и эквивалентная масса металла?
ЗАДАНИЕ 7
Сравнить количество молекул в 1 кг H2SO4 и в 1 кг HNO3.
Определить соотношение объемов равных масс СО2 и SO2 при нормальных условиях.
Определить давление кислорода, если 0,1 кг его находится в сосуде объемов 0,02 м3 при 200С.
Мышьяк образует два оксида, содержащих 65,2 и 75,7 масс % As. Определить эквивалентную массу As в этих оксидах.
При взаимодействии 13 г метала (I) с водой выделяется 3,73 л водорода (н.у.). Определить эквивалентную и атомную массы металла.
ЗАДАНИЕ 8
В каком объеме H2S при н.у. содержится столько же молекул, сколько их в 1 л воды при 200 С?
Во сколько раз объем 10 г H2S при н.у. больше, чем объем такого же количества SO3?
Сколько CaCO3 надо взять при 150 С и 104 кПа, чтобы при его прокаливании получилось 25 мл СО2?
При восстановлении 8,1 г металла (III) водородом получилось 1,8 г воды, эквивалентная масса которой 9 г/моль. Определить эквивалентную и атомную массу металла.
Эквивалентная масса металла (II) 12 г/моль. Определить процентное содержание кислорода в оксиде данного металла.
ЗАДАНИЕ 9
Определить массу азота, содержащую 18.1024 молекул.
Во сколько раз объем 0,01 кг водорода больше, чем такого же количества СО2 (н.у.)?
Определить давление 50 г этилена в сосуде объемом 10 л при -20 С.
Определить эквивалентную массу элемента, если его соединение с серой содержит 13,8 масс % серы, эквивалентная масса которой 16,03 г/моль.
При восстановлении 8,06 г оксида метала бериллием (эквивалентная масса 4,5 г/моль) получено 5 г оксида бериллия. Определить эквивалентную массу металла.
ЗАДАНИЕ 10
В каком количестве кислорода содержится 2.1026 молекул?
Сколько молей О2 получится при разложении 245 г KClO3?
Вычислить объем 0,1 кг газовой смеси состава 3СО + 2СО2 при 500 С и давлении 98600 Па.
При нагревании в кислороде 0,954 г металла (II) получили 1,194 г его оксида. Определить эквивалентную и атомную массы металла.
На восстановление 31,2 г оксида металла (III) пошло 10,6 г алюминия с эквивалентной массой 9 г/моль. Определить эквивалентную и атомную массы металла.
ЗАДАНИЕ 11
Какое количество молекул содержится: а) а 1 г Н2 и О2; б) 1 л Н2 и О2?
Чему равно отношение объемов, равных масс метана и ацетилена, взятых при одинаковых условиях?
При 170 С и давлении 104 кПа масса 624 л газа составляет 156 г. Определить молярную массу газа.
1 г четырехвалентного элемента соединяется с 0,27 г кислорода. Определить атомную массу элемента.
Элемент образует гидрид, содержащий 8,87 масс % водорода (Н). Вычислить эквивалентную массу элемента.
ЗАДАНИЕ 12
Во сколько раз число молекул в 10 г N2 больше, чем в таком же количестве CS2?
Чему равно отношение масс, содержащих одинаковое число молей водорода и кислорода?
Определить массу водорода, содержащегося в баллоне емкостью 25 л при 150 С и давлении 8 атмосфер.
Оксид металла содержит 28,53 масс % кислорода. Определить эквивалентную массу металла.
При восстановлении водородом 1,34 г оксида металла образовалось 0,324 г воды. Определить эквивалентную массу металла.
ЗАДАНИЕ 13
Сколько молекул содержится в 1 эквиваленте водорода и кислорода?
Чему равно отношение масс, содержащих одинаковое число молей азота и аммиака?
Вычислить объем, занимаемый 4,4 г СО2 при 110 С и 110 кПа.
При разложении 0,291 г оксида серебра получили 0,253 г серебра. Определить эквивалентную массу серебра.
Элемент образует оксид, содержащий 31,58 масс % кислорода (О). Вычислить эквивалентную массу элемента.
ЗАДАНИЕ 14
В каком количестве СО2 содержится 18,06.1026 молекул?
Определить массу СО2, содержащую столько же молей, сколько их содержится в 10 г водорода.
Баллон емкостью 10 л вмещает при 270С один моль кислорода. Вычислить давление кислорода в баллоне.
При восстановлении 1,305 г диоксида марганца было получено 0,825 г марганца. Определить ег эквивалентную массу.
На нейтрализацию 1 г основания пошло 0,91 г HCl. Определить эквивалентную массу основания.
ЗАДАНИЕ 15
В каком объеме хлора содержится 1022 молекул?
Определить массу азота, содержащую столько же молей вещества, сколько и в 18 г воды.
В баллоне емкостью 40 л находится 77 г СО2 при давлении 1,2 атмосферы. Вычислить температуру газа.
В состав углеводорода входит 25 масс % водорода и 75 масс % углерода. Определить эквивалентную массу углерода.
В каком количестве NaOH содержится столько же эквивалентов, сколько их в 140 г КОН?
Л А Б О Р А Т О Р Н Ы Е Р А Б О Т Ы
1. ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТНОЙ МАССЫ МЕТАЛЛА
А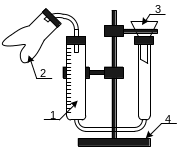 ).
Определение эквивалентной массы магния
на основе вытеснения им водорода из
водного раствора соляной кислоты. На
рис.1 представлена схема прибора для
определения эквивалентной массы металла.
).
Определение эквивалентной массы магния
на основе вытеснения им водорода из
водного раствора соляной кислоты. На
рис.1 представлена схема прибора для
определения эквивалентной массы металла.
Рис.1.
1 – стеклянная трубка
2 – двурогая насадка
3 – воронка
4 - штатив
Соберите прибор, как показано на рис.1. Полученную у лаборанта навеску металла (запишите ее) поместите в одну из частей двурогой насадки. В другую часть насадки осторожно налейте 5 мл раствора соляной кислоты концентрацией 1 моль/л. Проследите, чтобы кислота не попала на металл. Соедините при помощи пробки двурогую насадку с бюреткой.
Перед началом опыта проверяют герметичность прибора. Для этого необходимо поднять воронку. Если уровень воды в бюретке после некоторого подъема останется постоянным, то можно считать, что прибор герметичен. В противном случае необходимо более плотно надеть двурогую насадку на пробку.
Опуская или поднимая насадку совместите уровни воды в бюретке и воронке и запишите начальный уровень по делениям бюретки (определение проводят по нижнему мениску воды).
Повернув насадку перелейте кислоту к металлу. Наблюдайте выделение водорода, который будет вытеснять воду из бюретки в воронку. После окончания реакции (выделение газа прекращается) вновь совместите уровни воды в бюретке и в воронке и запишите конечное положение уровня воды. По разнице начального и конечного уровней рассчитайте объем выделившегося водорода.
По реакции Mg + 2HCl = MgCl2 + H2 и молярному весу магния рассчитайте его теоретическую эквивалентную массу.
Для расчета массы выделившегося водорода необходимо знать температуру и атмосферное давление в лаборатории (узнать у лаборанта). Парциальное давление водорода в бюретке определяется как разность между атмосферным давлением водорода и парциальным давлением насыщенных паров вода, которое можно узнать для данной температуры из приведенной ниже таблицы.
Давление насыщенных паров воды h (в кПа) для различных температур (t0 C)
t0 |
h |
t0 |
h |
t0 |
h |
t0 |
h |
15 |
1,71 |
18 |
2,07 |
21 |
2,48 |
24 |
2,99 |
16 |
1,81 |
19 |
2,47 |
22 |
2,64 |
25 |
3,17 |
17 |
1,93 |
20 |
2,33 |
23 |
2,81 |
26 |
3,36 |
Расчет массы выделившегося водорода провести по уравнению Клайперона – Менделеева в системе Си. Используя полученное значение, по закону эквивалентов рассчитать эквивалентную массу магния.
Используя теоретическое и экспериментально определенное значения массы магния, рассчитать относительную ошибку опыта: Δ = ЭТ-ЭПР/ЭТ.
Б) Определение эквивалентной массы алюминия на основе вытеснения им водорода из водных растворов щелочей. Последовательность выполнения опыта аналогична опыту 1А. Навеску Al получить у лаборанта. Для реакции использовать 10% раствор NaOH.
В) Определение молярной массы диоксида углерода.
Диоксид углерода получают в аппарате Киппа (рис.2) действием 10% раствора соляной кислоты на мрамор (CaCO3). Для удаления из СО2 хлористого водорода и осушки газа от паров воды диоксид углерода последовательно пропускают через дрексельные склянки 1 и 2, заполненные соответственно раствором гидрокарбоната натрия (NaHCO3) и концентрированной серной кислотой (H2SO4).
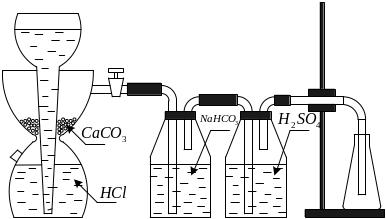
Рис.2
Полученную у лаборанта сухую колбу, закрытую пробкой, вставленной до отметки на горле колбы, взвешивают на весах (масса m1). Затем присоединяют колбу к лабораторной установке и заполняют ее выделившимся диоксидом углерода в течении 5 мин. Закрывают пробкой (до отметки) и взвешивают (масса m2). Вновь пропускают углекислый газ (2-3 мин.) и вновь взвешивают колбу (масса m3). Расхождение между m2 и m3 не должно превышать 0,01 г.
Определяют объем колбы, равный объему взвешенного СО2. Для этого заполняют колбу до отметки водой и измеряют ее объем в мерном цилиндре.
Температуру и давление в лаборатории необходимо узнать у лаборанта.
Для определения массы газа необходимо произвести следующие расчеты:
Привести объем СО2 к нормальным условиям.
Рассчитать массу воздуха в колбе, зная температуру, давление и объем колбы (масса m4).
Определить массу пустой колбы (масса m5): m5 = m1 – m4.
Рассчитать массу СО2 (m6): m6 = m3 – m5.
Рассчитать молярную массу СО2 и относительную ошибку опыта.
Взято с сайта ФАЭ helper (URL: http://www.faehelper.narod.ru)
