
2. Контрольні завдання
Загальні вказівки
При вирішенні задач необхідно вивчити відповідний теоретичний матеріал, заздалегідь розібрати і самому повторити вирішення типових задач в окремих розділах.
При вирішенні задач необхідно дотримувати наступні вимоги:
1) виписувати умови задач повністю, без скорочень;
2) супроводжувати рішення коротким пояснювальним текстом; при застосуванні діаграм приводити графічне зображення рішення і необхідні аналітичні залежності з достатнім поясненням;
3) приводити обчислення в розгорненому вигляді;
4) давати значення фізичних величин в системі СІ;
5) формулювати пояснення по ходу рішення завдань; не допускати скорочень і умовностей в тексті;
6) проводити короткий аналіз отриманих результатів рішення задачі і робити відповідні виводи;
Приклади вирішення задач
А. Рівняння стану ідеального газу
Рівняння Клапейрона:
для 1 кг
ідеального газу: ![]() ;
;
для М кг
ідеального газу ![]() ;
;
для
1 кмоля ідеального газу ![]() ,
,
де Р
‑ абсолютний
тиск газу,
Н/м2;
![]() ‑
питомий
об'єм газу,
м3/кг;
V
‑
об'єм
газу,
м3;
Vµ
‑
об'єм
1 кмоля
газу, м³; µ
‑
маса
1 кмоля
газу,
кг; R
– газова
стала,
віднесена
до 1 кг газу,
Дж/(кгК);
Т
‑
абсолютна температура газу,
К.
‑
питомий
об'єм газу,
м3/кг;
V
‑
об'єм
газу,
м3;
Vµ
‑
об'єм
1 кмоля
газу, м³; µ
‑
маса
1 кмоля
газу,
кг; R
– газова
стала,
віднесена
до 1 кг газу,
Дж/(кгК);
Т
‑
абсолютна температура газу,
К.
Газова стала, віднесена до 1 кг газу:
![]() ,
Дж/(кгК);
,
Дж/(кгК);
де 8314 ‑ універсальна газова стала 1 кмоля газу, Дж /(кмоль·К).
Абсолютний тиск газу визначається із наступних співвідношень:
‑ якщо абсолютний тиск більше тиску навколишнього середовища
![]() ,
Н/м²,
,
Н/м²,
де Рн ‑ надмірний тиск, вимірюваний манометром, Н/м²;
В ‑ тиск навколишнього середовища, вимірюваний барометром, Н/м²;
‑ якщо абсолютний тиск менше тиску навколишнього середовища
![]() ,
Н/м²,
,
Н/м²,
де РВ ‑ розрідження, вимірюване вакуумметром, Н/м².
Приклад 1. Визначте температуру кисню, який знаходиться в резервуарі місткістю V = 10 м3 за умови, що на манометрі Рн = 7·105 Н/м², барометричний тиск В = 740 мм рт.ст., масса газу М=100 кг.
Рішення. З рівняння Клапейрона для маси М кг газу Т = PV/(MR). Тоді:
![]() Н/м²;
Н/м²;
![]() Дж/(кгК);
Дж/(кгК);
![]() K.
K.
Б. Теплоємність газів
Теплоємність газів ‑ це кількість теплоти, що потрібна для нагріву (або охолоджування) одиниці кількості речовини на 1ºС. Розрізняють відповідно масову с кДж/(кг·К); об'ємну с' [кДж/(м3·К) ] і молярну µс [кДж/(кмоль·К)] теплоємності.
Залежно
від умов нагріву (або охолоджування)
розрізняють відповідно ізохорну
![]() ,
,
![]() ,
,
![]() і
ізобарну
і
ізобарну
![]() ,
,
![]() ,
,
![]() теплоємності.
теплоємності.
Теплоємність ‑ величина змінна і значення теплоємностей ідеальних газів зростають з підвищенням температури. Тому в розрахунках витрати теплоти для нагріву газу використовується не дійсна, а середня теплоємність в заданому інтервалі температур, наприклад:
![]() ,
,
де QР ‑ кількість підведеної теплоти до М кг газу при нагріві в інтервалі температур від t1 і до t2 при постійному тиску, кДж;
![]() ‑ середня
масова теплоємність при постійному
тиску в інтервалі температур від t1
до t2,
кДж/(кг
К),
‑ середня
масова теплоємність при постійному
тиску в інтервалі температур від t1
до t2,
кДж/(кг
К),
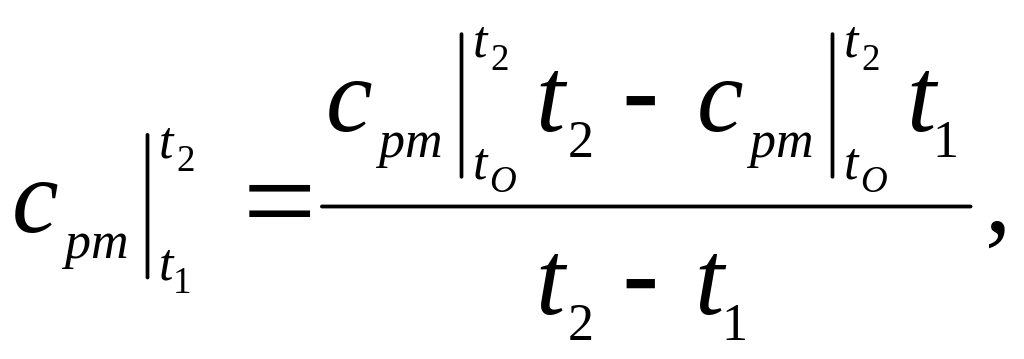
де
![]() і
і
![]() ‑
середні
теплоємності при постійному тиску в
інтервалі температур від
0 до t1
і
t2,
визначувані
за відповідними таблицями.
‑
середні
теплоємності при постійному тиску в
інтервалі температур від
0 до t1
і
t2,
визначувані
за відповідними таблицями.
В деяких розрахунках, що не вимагають великої точності, можна допустити, що c=const, тобто теплоємність не залежить від температури, тоді масові і об'ємні теплоємності визначають з молярних, залежних тільки від атомності газів. Зв'язок між молярною, масовою і об'ємною теплоємностями представлений таким чином:
![]()
![]()
![]() ,
,
де 0 – густина газу за нормальних умов.
Наближені значення молярних теплоємностей при постійному тиску (с=const) наведені в табл. 2.1.
Таблиця 2.1.
-
Параметр
Газ
одноатомний
двоатомний
трьох- і багатоатомний
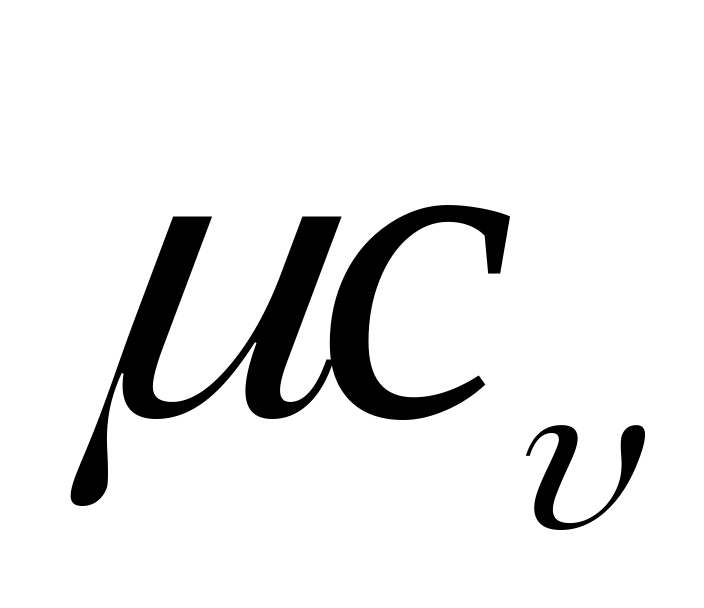 ,
кДж/(кмоль·К)
,
кДж/(кмоль·К)12,56
20,93
29,31
μcp, кДж/(кмоль·К)
20,93
29,31
37,68
Приклад 2.
Визначте середню відповідно масову
![]() и об’ємну
и об’ємну
![]() теплоємність
повітря в процесі V=const
в
межах температур від t1=200°С
до t2=500°С,
вважаючи,
що залежність теплоємності від температури
криволінійна.
теплоємність
повітря в процесі V=const
в
межах температур від t1=200°С
до t2=500°С,
вважаючи,
що залежність теплоємності від температури
криволінійна.
Рішення
![]() ,
кДж/(кг·К);
,
кДж/(кг·К);
![]() ,
кДж/(м3·К)
,
кДж/(м3·К)
Приклад 3. Визначте кількість теплоти, яку потрібно підвести до резервуару місткістю V0 = 3 м3 CO2 при Р = 7·10 Н/м², для нагріву від температури t1= 200°С до t2= 700°С в процесі Р=const. Теплоємність прийняти постійною.
Рішення (у двох варіантах):
Варіант 1.
![]()
З
характеристичного рівняння маса газу
![]()
де
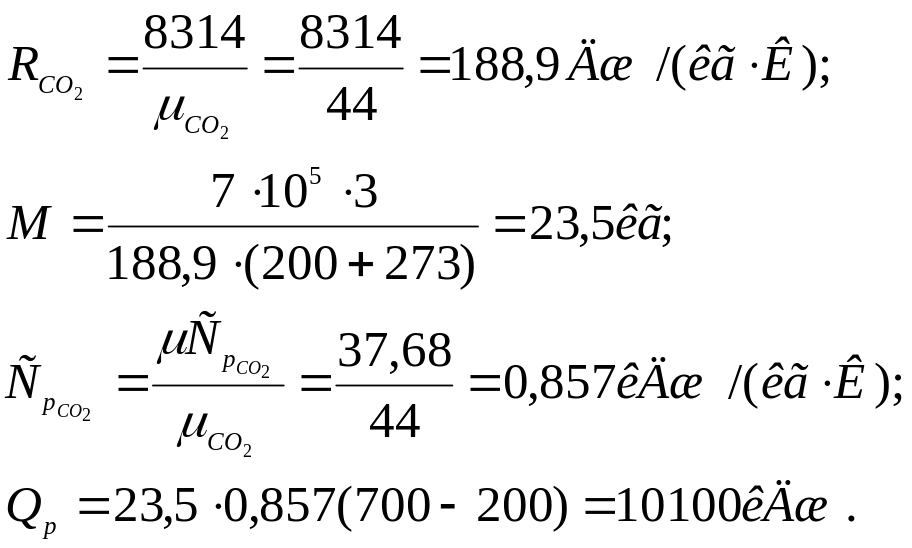
Варіант 2.
![]()
Об'єм газу за нормальних умов з рівняння об'єднаного закону Гей-Люсака і Бойля – Маріота:
![]()
де Р, V0 , Т ‑ задані відповідно тиск, об'єм і температура газу ; Рн, Vн, Тн ‑ ті ж параметри за нормальних умов.
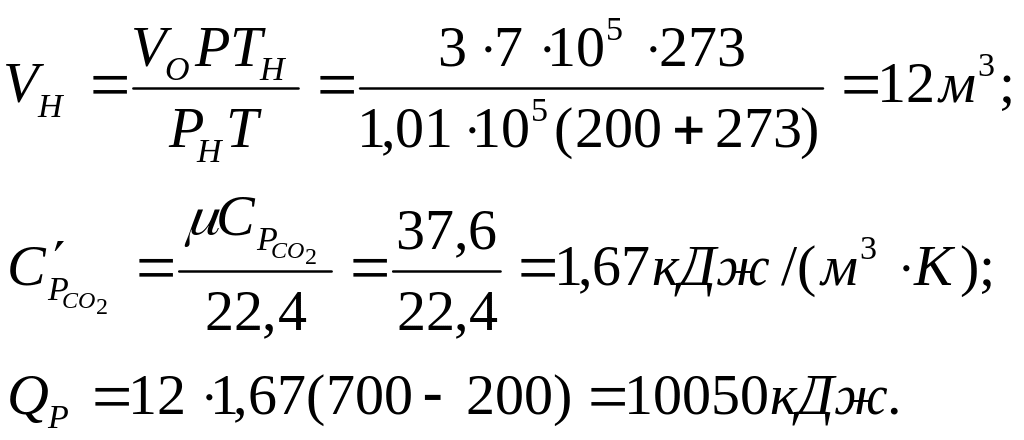
Як видно з рішень по обох варіантах, кількості підведеної теплоти приблизно однакові.
В. Газові суміші
Газова
суміш ‑ це механічна суміш газів, що
не вступають в хімічні реакції між
собою. Вона може бути задана масовими,
об'ємними або молярними частками. Масовою
часткою називають відношення маси Мi
кожного газу, що входить в суміш, до
загальної маси М суміші:
![]() .
Об'ємною часткою називають відношення
приведеного об'єму Vi
газу до загального об'єму суміші Vсум
газів:
.
Об'ємною часткою називають відношення
приведеного об'єму Vi
газу до загального об'єму суміші Vсум
газів:
![]()
де
Vi
‑
приведений об'єм, тобто об'єм, який займав
би компонент газу при певній температурі
і тиску суміші
![]()
Молярною часткою називається відношення числа молей Ki кожного газу до числа молей суміші К ‑ Кi /К. Молярна частка чисельно дорівнює об'ємній частці:
![]()
Газова постійна суміші газів розраховується залежно від способу завдання суміші
![]() або
або
![]() .
.
Середня (уявна) молярна маса суміші
![]() або
або
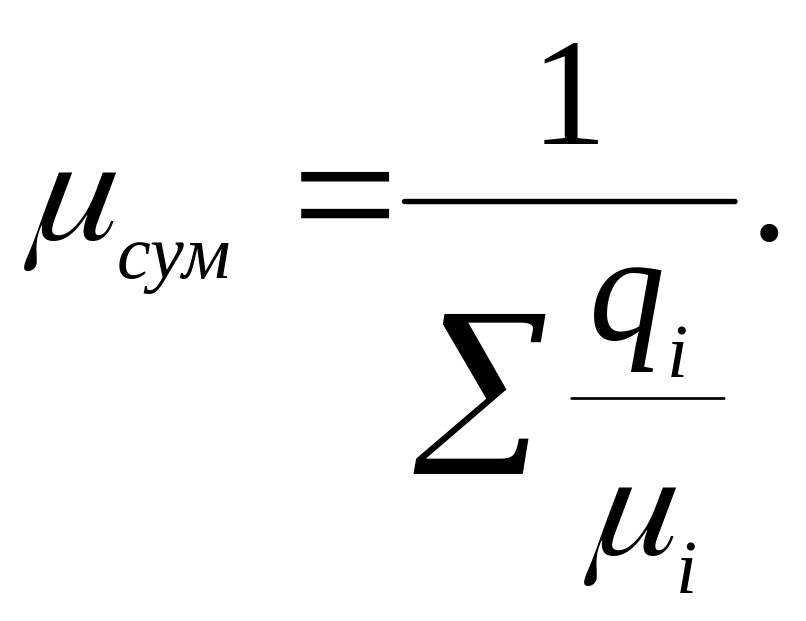
Парціальний
тиск кожного газу дорівнює добутку
загального тиску суміші на його об'ємну
частку:
![]()
Параметри газової суміші можуть бути обчислені з рівняння Клапейрона PV=MRT, де всі величини, що входять в рівняння, відносяться до суміші газів.
Приклад 4.
Об'ємний склад сухих продуктів згоряння
палива наступний,
%:
![]() Знайти уявну молярну масу, газову
постійну, густину і питомий об'єм
продуктів згоряння при В=750 мм
рт.ст., t
=
800°С.
Знайти уявну молярну масу, газову
постійну, густину і питомий об'єм
продуктів згоряння при В=750 мм
рт.ст., t
=
800°С.
Рішення
![]() кг/моль;
кг/моль;
![]() Дж/(кгK);
Дж/(кгK);
![]()
![]() м3/кг;
м3/кг;
![]() кг/м3.
кг/м3.
Г. Термодинамічні процеси ідеального газу
Термодинамічним процесом називають зміну параметрів стану робочого тіла. Існує нескінченна кількість термодинамічних процесів, їх називають політропними, і зміна параметрів в них підкоряється рівнянню: PVn = const, де n ‑ показник політропи.
Окремими процесами є ізохорний (V=const), ізобарний (P=const), ізотермічний (T=const) і адіабатний (dq=const), який протікає без відведення і підведення теплоти. Для будь-якого процесу зміна внутрішньої енергії 1 кг газу обчислюється за виразом:
![]()
при
![]()
![]()
зміна ентальпії:
![]()
при
![]()
![]()
зміна ентропії:
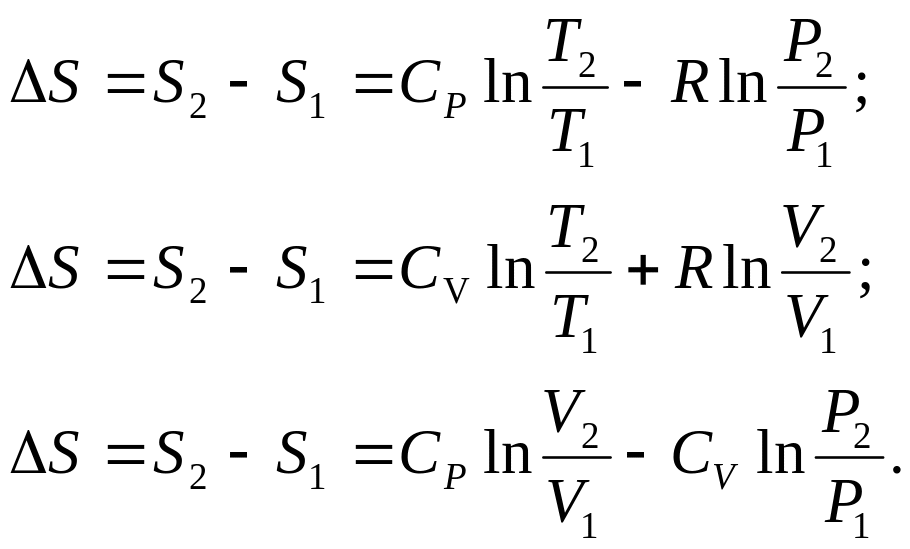
Приклад 5. В закритій посудині знаходиться повітря при тиску Р1=5 бар і температурі t1 = 27С. Визначте тиск повітря після охолоджування до 0°С. Покажіть процес в P‑V і Т‑S -координатах.
Рішення.
Залежність між початковими і кінцевими
параметрами в ізохорному процесі
наступна:
![]() .
Тоді
.
Тоді
![]() бар.
бар.
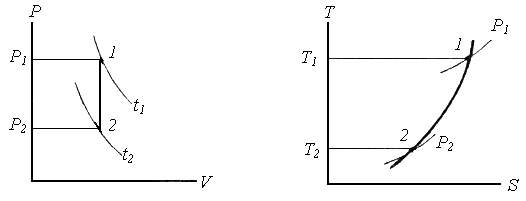
Приклад 6. Визначте роботу ізобарного розширення азоту масою 7 кг при нагріванні в інтервалі температур від t1=2000С до t2=6000С. Покажіть процес в P‑V і Т‑S -діаграмах.
Рішення. Робота розширення
![]() ,
,
де М ‑ маса газу, R ‑ газова постійна, Дж/(кгK); t1, t2 ‑ відповідно початкова і кінцева температура азоту, 0С.
![]() Дж/(кгK);
Дж/(кгK);
![]() Дж
831 кДж.
Дж
831 кДж.
Приклад 7. 0,2 кг кисню при температурі t1=250С розширюється ізотермічно до триразового збільшення об'єму. Визначте кількість теплоти, що надається тілу.
Рішення. Оскільки в ізотермічному процесі вся підведена теплота йде на здійснення роботи, то
![]()
де Q ‑ підведена теплота, Дж; М ‑ маса газу, кг; R ‑ газова постійна, Дж/(кг·К); Т – температура газу, К; V1 і V2 ‑ відповідно початковий і кінцевий об'єм, м3.
![]() кДж.
кДж.
Приклад 8. Газ СО при тиску Р1=0,9 бар і початковій температурі t1=120С адіабатно стискається до тиску Р2=3,6 бара. Визначте температуру в кінці стиснення.
Рішення. Кінцеву температуру визначають із співвідношення параметрів Р і Т в адіабатному процесі:
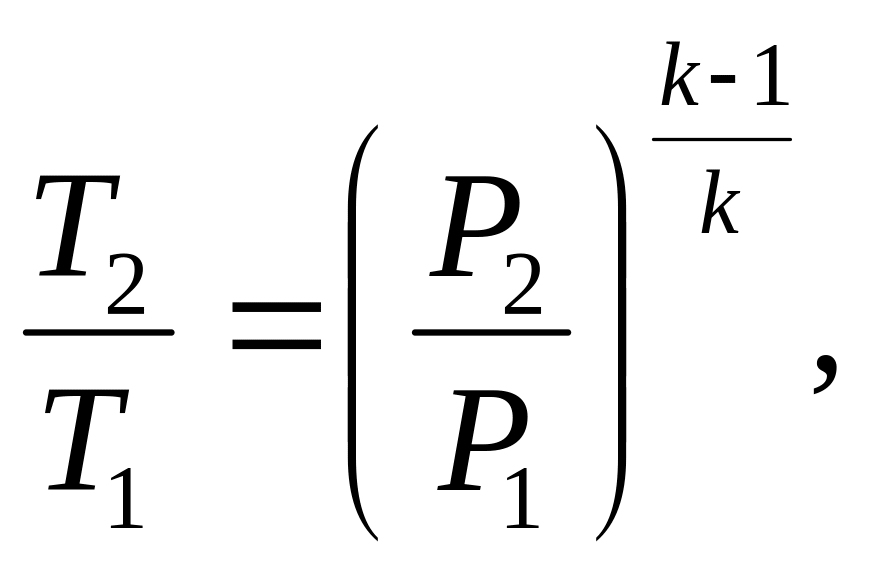
де k – показник адіабати. Для двоатомного газу k=1,4. Тоді
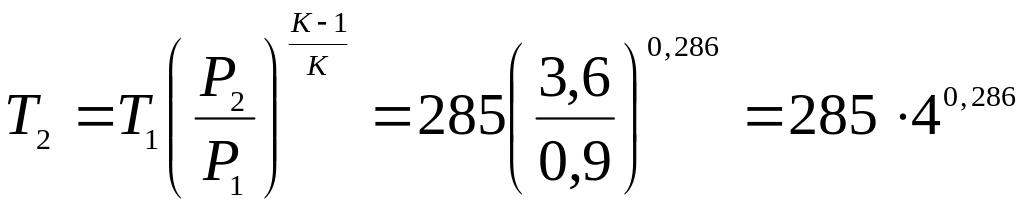 .
.
Позначимо
![]() через N.
lg
N
=
0,286ln4
=
0,286·0,602
=
0,172.
Звідси
N=1,49.
Отже
T2=285·1,49
=
425 K.
через N.
lg
N
=
0,286ln4
=
0,286·0,602
=
0,172.
Звідси
N=1,49.
Отже
T2=285·1,49
=
425 K.
Д. Термодинамічні процеси зміни стану водяної пари
Водяна пара – робоче тіло в парових турбінах і машинах, теплоносій в різних теплообмінниках і т.д. Водяна пара не може розглядатися як ідеальний газ і до неї не застосовні залежності, отримані для ідеальних газів, в тих випадках, коли вони є робочим тілом парових установок.
Графічне зображення термодинамічних процесів з водяною парою
Ізохорний процес (V=const ). На P‑V -діаграмі ізохору зображують відрізком прямої, паралельної осі ординат; на T‑S -діаграмі ‑ в області вологої насиченої пари ‑ кривою лінією з опуклістю вгору, а в області перегрітої пари ‑ опуклістю вниз.
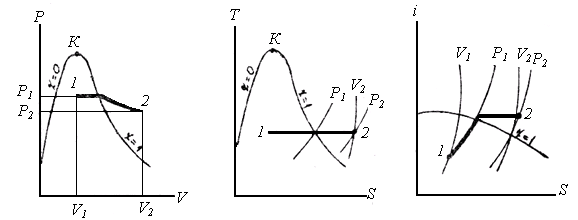
Ізобарний процес (P=const). На P‑V-діаграмі ізобару зображують горизонтальною прямою лінією; на T‑S-діаграмі ‑ в області вологої пари ізобара є одночасно і ізотермою, і її зображають горизонтальною прямою; в області перегрітої пари ‑ кривою з опуклістю вниз; на I‑S-діаграмі в області вологої пари – це похила пряма, а в області перегрітої пари ‑ крива з опуклістю вниз.
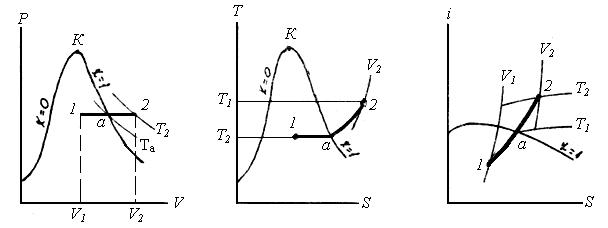
Ізотермічний процес (T=const). На P‑V-діаграмі ізотерму зображають в області вологої пари горизонтальною прямою, в області перегрітої пари ‑ кривою з опуклістю вниз; на T‑S-діаграмі ‑ це горизонтальна пряма. В I‑S-діаграмі в області вологої пари ізотерма співпадає з ізобарою, а в області перегрітої пари її зображають кривою з опуклістю вгору.
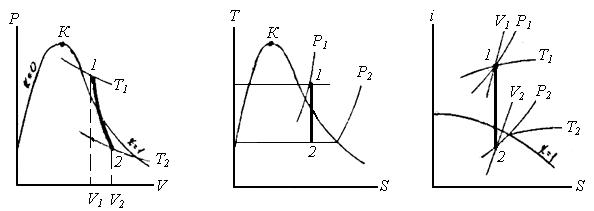
Адіабатний процес. На P‑V-діаграмі адіабату зображають кривою з опуклістю вниз, що йде в області вологої пари більш полого, ніж в області перегрітої пари; на T‑S і I‑S-діаграмах – це вертикальні прямі.
Основні розрахункові формули для процесів, в яких водяна пара є робочим тілом, зведені в табл. 2.2.
Таблиця 2.2
Основні розрахункові формули
Найменування процесу |
Зміна внутрішньої енергії |
Теплота, яка бере участь в процесі |
Робота процесу |
Ізохорний |
|
|
|
Ізотермічний |
|
|
|
Ізобарний |
|
|
|
Адіабатний |
|
|
|
Значення параметрів для сухої насиченої пари, води і перегрітої пари беруть з таблиць водяної пари. Значення параметрів вологої насиченої пари визначають за такими формулами:
vx = v'(1-x) + v"x; ix = i'(1-x) + i"x; Sx = S'(1-x) + S"x;
де x ‑ ступінь сухості; ', i', S' і '', i'', S'' – питомий об'єм, ентальпія і ентропія відповідно киплячої рідині і сухої насиченої пари (беруть з таблиць водяної пари).
Необхідні значення параметрів для будь-якої пари також можуть бути визначені по I‑S-діаграмі, але з меншою точністю.
Приклад 10. Визначте кількість теплоти, що підводиться до 2 кг вологої насиченої пари в процесі =const при P=0,55 МПа і ступені сухості x=0,9 для отримання сухої насиченої пари.
Рішення.
Теплота, що підводиться
![]() ;
;
U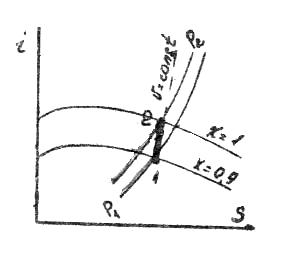 1
= M
(i1
‑
P1
1);
1
= M
(i1
‑
P1
1);
U2 = M (i2 ‑ P2 2).
По I‑S-діаграмі водяної пари знаходимо:
i1=2547 608 кДж/кг; i2=2765 660 кДж/кг;
1=0,3 м3/кг; 2=0,3 м3/кг; P2=0,64 МПа.
Тоді
![]() кДж;
кДж;
![]() кДж;
кДж;
![]() кДж.
кДж.
П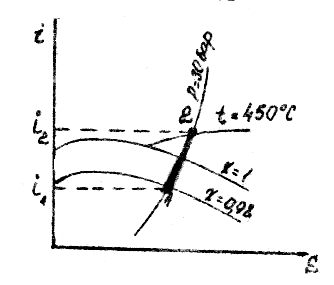 риклад 11.
Визначте кількість теплоти, що витрачається
на перегрів 5 кг вологої насиченої
пари із ступенем сухості
x=0,98
при Р=const=3 МПа
до температури
t = 450°С.
риклад 11.
Визначте кількість теплоти, що витрачається
на перегрів 5 кг вологої насиченої
пари із ступенем сухості
x=0,98
при Р=const=3 МПа
до температури
t = 450°С.
Рішення. По I‑S-діаграмі водяної пари знаходимо: i1 = 2765 кДж/кг; i2 = 3344 кДж/кг.
Тоді:
![]() кДж.
кДж.
Приклад 12. 1 кг вологої насиченої пари при P1=1,5 МПа і x1= 0,8 ізотермічно розширюється до P2= 0,8 МПа. Визначте кількість теплоти, зміну внутрішньої енергії і роботу розширення.
Рішення
По I‑S-діаграмі знаходимо:
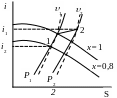 1
= 0,105 м3/кг; 2
= 0,25 м3/кг;
1
= 0,105 м3/кг; 2
= 0,25 м3/кг;
i1 = 2400 кДж/кг; i2 = 2832 кДж/кг;
S1 = 5,61 кДж/(кг·К);
S2 = 6,79 кДж/(кг·К).
Кількість теплоти:
Q = T(S2-S1) = (198 + 273)·(6,79 ‑ 5,61) =
=556 кДж/кг.
Внутрішня енергія в початковому стані:
![]() Дж/кг.
Дж/кг.
Внутрішня енергія в кінцевому стані:
![]() Дж/кг.
Дж/кг.
Робота розширення
і = q – ΔU = 556 – (2632 ‑ 2242) = 166 кДж/кг.
Е. Паливо. Матеріальний і тепловий баланси процесу горіння
Елементарний склад твердих і рідких палив записується у вигляді суми вмісту в них вуглецю С, водню Н, кисню О, сірки S, азоту N, золи А і вологи W у відсотках на 1 кг палива. Залежно від того, яка маса палива береться в розрахунок, кожному числу привласнюється відповідний надрядковий індекс:
горюча ![]() ;
;
суха ![]() ;
;
робоча ![]() .
.
Елементарний склад палива з однієї маси на іншу перераховують згідно з формулами табл. 2.3.
Таблиця 2.3
Коефіцієнти перерахунку мас палива
Задана маса палива |
Маса палива, на яку робиться перерахунок |
||
горюча |
суха |
робоча |
|
горюча |
1 |
|
|
суха |
|
1 |
|
робоча |
|
|
1 |
Перерахунок елементарного складу палива з однієї вологості (зольності) на іншу ведеться за формулами, %:
![]()
![]()
За відсутності табличних даних теплоту згоряння палив необхідно визначати в калориметричних бомбах. Для орієнтовних розрахунків нижча теплота згоряння твердих або рідких палив може бути розрахована по формулі Менделєєва, ккал/кг:
![]() ,
,
або кДж/кг:
![]() .
.
Вища і нижча теплоти згоряння робочої маси зв'язані виразом:
![]() .
.
Для порівняння теплової цінності різних видів палива використовують умовне паливо, яке має теплоту згоряння, рівну 29300 кДж/кг. Витрату натурального палива на умовне перераховують за формулою:
Ву = ВЕ,
де Bу і В ‑ витрата відповідно умовного і натурального палива, кг/с; Е ‑ тепловий еквівалент палива
![]() .
.
Мінімальна (теоретична) кількість повітря, необхідна для повного спалювання 1 кг твердого або рідкого палива при α = 1,0 м3/кг:
![]()
Дійсна кількість повітря визначається добутком коефіцієнта надлишку повітря і теоретичної кількості повітря, м3/кг:
![]() .
.
Об'єм продуктів згоряння, що утворилися при спалюванні 1 кг палива в теоретично необхідній кількості повітря
![]()
де об'єми продуктів згоряння кожного компоненту відповідно будуть:
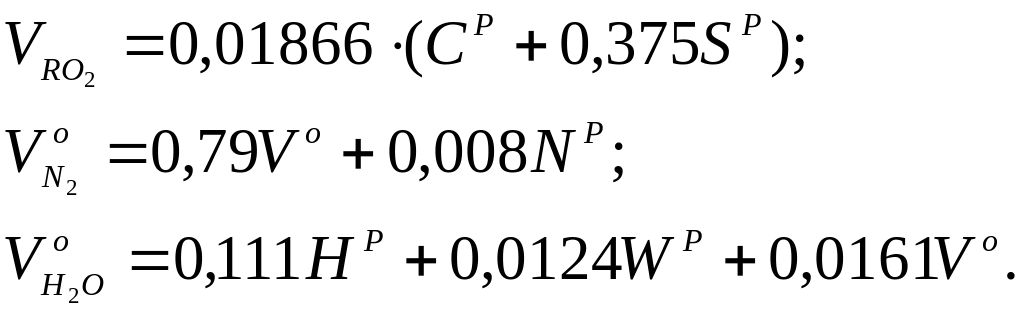
Об'єм продуктів згоряння при спалюванні 1 кг палива і дійсній кількості повітря, м3/кг:
![]()
Ентальпія
продуктів згоряння IГ
(кДж/кг), (кДж/м3)
при α=1 визначається
як сума добутків об'єму елементарних
продуктів згоряння, їх питомої теплоємності
С,
температури
θ,
ентальпії надмірного повітря
![]() і
золи IЗ:
і
золи IЗ:

де
![]() ‑
теоретичні
об'єми продуктів згоряння палива і
повітря,
м3/кг,
м3/м3;
αун
– частка
золи, що виноситься газами;
СЗ
– питома
теплоємність золи,
кДж/(кг·К).
‑
теоретичні
об'єми продуктів згоряння палива і
повітря,
м3/кг,
м3/м3;
αун
– частка
золи, що виноситься газами;
СЗ
– питома
теплоємність золи,
кДж/(кг·К).
Елементарний склад газоподібних палив звичайно приводиться як процентний вміст окремих газів: оксиду вуглецю СО, водню Н2, метану СН4, етану С2Н6, кисню О2, азоту N2 та інших.
Теплота згоряння газоподібних палив підраховується як сума добутків теплоти згоряння окремих компонентів і їх вмісту в 1 м3 газоподібного палива, МДж/м3:
![]()
Мінімальний (теоретичний) об'єм повітря, необхідний для спалювання 1 м3 газоподібного палива, м3/м3:
![]() .
.
Теоретичний об'єм азоту:
![]() .
.
Об'єм трьохатомних газів:
![]() .
.
Об'єм сухих газів:
![]()
Теоретичний об'єм водяної пари:
![]()
де dГ – вологовміст газоподібного палива, віднесений до 1 м3 сухого газу, г/м3.
Дійсний об'єм продуктів згоряння при α >1, м3/м3:
![]() .
.
(При спалювання сланців об'єми продуктів згоряння обчислюються з поправкою на розкладання карбонатів К).
Розрахунковий зміст золи з урахуванням карбонатів, що розклалися, %:
![]()
Об'єм вуглекислоти, м3/кг;
![]()
Об'єм газів, м3/кг:
![]() .
.
При спалюванні суміші палив об'єми і ентальпії продуктів згоряння пропонується розраховувати для кожного палива окремо на 1 кг твердого або рідкого і на 1 м3 газоподібного палива.
По отриманих для кожного палива значень Vo, VRO2, VN2 визначаються об'єми повітря і продуктів згоряння суміші, м3/кг. Для суміші двох однорідних палив (твердих, рідких або газоподібних):
![]()
![]()
де g' – масова частка першого палива в суміші.
По
аналогічних формулах визначають
![]() суміші.
Розрахунок
ведеться на 1 кг твердого або рідкого
палива. Для суміші твердого або рідкого
палива з газоподібним паливом заздалегідь
визначається кількість газу Х,
що
приходиться на 1 кг
палива.
суміші.
Розрахунок
ведеться на 1 кг твердого або рідкого
палива. Для суміші твердого або рідкого
палива з газоподібним паливом заздалегідь
визначається кількість газу Х,
що
приходиться на 1 кг
палива.
Об'єм повітря, м3/кг:
![]()
Аналогічно розраховують об'єми вуглекислоти, азоту, водяної пари. Питома теплоємність продуктів згоряння (середня), кДж/(м3·К):
![]()
Теоретична температура горіння:

Коефіцієнт надлишку повітря за даними газового аналізу продуктів згоряння визначають по наступних формулах:
- при повному згорянні палива, коли в продуктах згоряння відсутні продукти неповного горіння
![]()
- при вмісті в продуктах згоряння горючих компонентів спочатку визначають надмірний вміст кисню, %:
![]()
а
потім по формулі
![]() –
коефіцієнт надлишку повітря.
–
коефіцієнт надлишку повітря.
Приклад 13. Визначте кількість повітря, теоретично необхідну для спалювання 1 кг палива наступного складу, %: CP=37,2; HP=2,6; SP=0,6; NP=0,4; OP=12; WP=40; AP=7,2, а також об'єм продуктів згоряння при коефіцієнті надлишку повітря α = 1,2.
Рішення. Визначаємо теоретично необхідну кількість повітря:
![]()
![]() ,
м3/кг.
,
м3/кг.
Визначаємо об'єм продуктів згоряння, м3/кг:
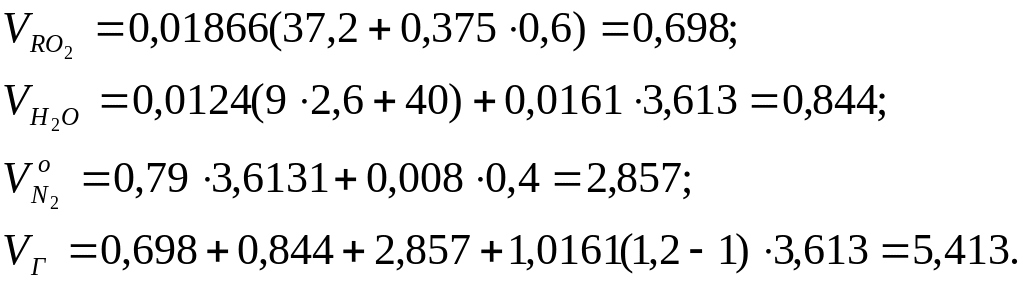
Приклад 14.
Визначте нижчу і вищу теплоти згоряння
робочої маси вугілля марки Д,
якщо
склад його горючої маси,
%: CГ=78,5;
HГ=5,6;
![]() =0,4;
NГ=2,5;
OГ=13.
Зольність
сухої маси AС=15,0
% і
вологість WP=12,0
%.
=0,4;
NГ=2,5;
OГ=13.
Зольність
сухої маси AС=15,0
% і
вологість WP=12,0
%.
Рішення. Користуючись коефіцієнтами перерахунку з табл. 2.3, визначаємо зольність робочої маси палива Ар і склад робочої маси, %:
![]()
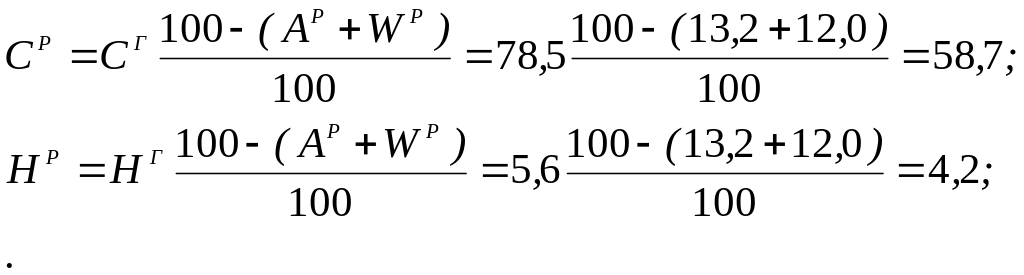
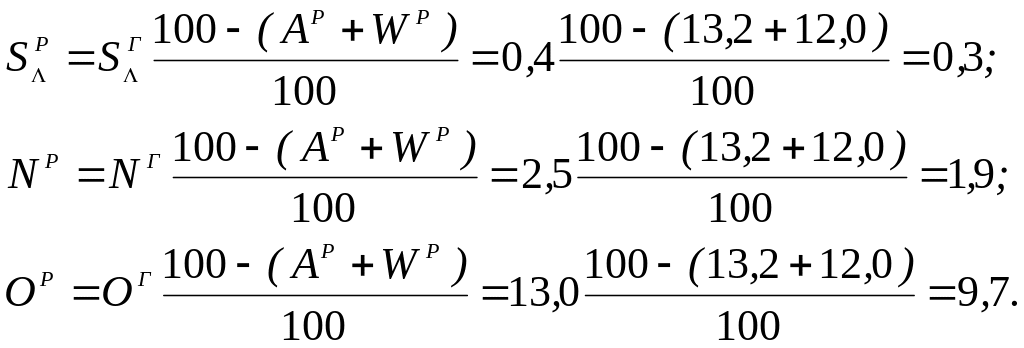
Нижча теплота згоряння робочої маси палива:
![]()
![]() ,
кДж/кг.
,
кДж/кг.
Вища теплота згоряння:
![]() кДж/кг.
кДж/кг.
Ж. Вторинні енергоресурси
Використання теплоти відхідних газів для отримання гарячої води і пари
Відхідні котельні гази використовують у водяних утилізаторах (економайзерах) і в котлах-утилізаторах для отримання гарячої води і пари.
Витрата відхідних газів з котельні, м3/с:
![]()
де
n
‑
кількість котлоагрегатів;
BP
‑
розрахункова
витрата палива,
кг/с;
![]() і
і
![]() ‑
теоретично
необхідний об'єм відповідно газів і
повітря,
м3/кг
(м3/м3);
αУ
– коефіцієнт
надлишку повітря за утилізатором;
θ – температура
газів на вході в утилізатор,
oC.
‑
теоретично
необхідний об'єм відповідно газів і
повітря,
м3/кг
(м3/м3);
αУ
– коефіцієнт
надлишку повітря за утилізатором;
θ – температура
газів на вході в утилізатор,
oC.
Кількість теплоти, що віддається відхідними котельними газами утилізатору, кДж/с:
![]()
де
![]() ‑
середня
витрата відхідних газів при їх
охолоджуванні в утилізаторі від θ
до θ',
м3/с;
‑
середня
витрата відхідних газів при їх
охолоджуванні в утилізаторі від θ
до θ',
м3/с;
![]() ‑ середня
об'ємна теплоємність газів,
кДж/(м3·К);
‑ середня
об'ємна теплоємність газів,
кДж/(м3·К);
θ' ‑ температура газів на виході з утилізатора, oC.
Використання теплоти пічних відхідних газів для отримання пари
Кількість виробленої теплоти у вигляді пари в утилізаторі за рахунок теплоти відхідних газів, кДж/с:
![]()
де
ІГ,
ІГ
‑
ентальпія
газів на виході відповідно з печі і з
утилізатора,
кДж/кг (кДж/м3);
β
‑
коефіцієнт,
що враховує невідповідність режиму і
кількості годин роботи утилізатора і
агрегату ‑ джерела вторинних
енергоресурсів;
![]() ‑
коефіцієнт
втрат теплоти утилізатора в навколишнє
середовище.
‑
коефіцієнт
втрат теплоти утилізатора в навколишнє
середовище.
Економія умовного палива за рахунок вторинних ресурсів, кг/с:
![]()
де
![]() ‑
ККД
котельні, що заміщається.
‑
ККД
котельні, що заміщається.
Приклад 15.
Визначити
економію умовного палива при використанні
виробленої теплоти у вигляді пари в
котлі-утилізаторі за рахунок теплоти
відхідних газів двох печей, якщо
температура газів на виході з печей θ
=
700оС,
на
виході з котла-утилізатора
θ'
= 200оС,
коефіцієнт
надлишку повітря за котлом-утилізатором
αУ=1,35.
Розрахункова
витрата палива двох печей BP=0,036
м3/с,
коефіцієнт,
що враховує невідповідність режиму і
числа годин роботи котла-утилізатора
і печей
β=1,0;
коефіцієнт
втрат теплоти котла-утилізатора в
навколишнє середовище
=0,12 і
ККД котельні, що заміщається,
![]() =0,86.
Печі
працюють на природному газі Шебелінського
родовища складу,
%:
СН4
= 94,1; С2Н6
= 3,1;
С3Н8 = 0,6;
С4Н10
= 0,2;
С5Н12
= 0,8; N2
= 1,2.
=0,86.
Печі
працюють на природному газі Шебелінського
родовища складу,
%:
СН4
= 94,1; С2Н6
= 3,1;
С3Н8 = 0,6;
С4Н10
= 0,2;
С5Н12
= 0,8; N2
= 1,2.
Рішення. Теоретично необхідний об'єм повітря
![]()
![]() м3/м3.
м3/м3.
Об'єм трьохатомних газів
![]()
![]() м3/м3.
м3/м3.
Теоретичний об'єм азоту
![]() м3/м3.
м3/м3.
Теоретичний об'єм водяних газів
![]()
![]() м3/м3.
м3/м3.
Ентальпія газів на виході з печей
![]()
![]() кДж/м3.
кДж/м3.
Ентальпія газу на виході з котла-утилізатора
![]()
![]() кДж/м3.
кДж/м3.
(значення питомих ентальпій газів і золи беруться з додатку).
Кількість виробленої теплоти у вигляді пари в котлі-утилізаторі за рахунок теплоти відхідних газів
![]() кДж/с.
кДж/с.
Економія умовного палива при використанні виробленої теплоти у вигляді пари в котлі-утилізаторі за рахунок теплоти відхідних газів
![]() кг/с,
кг/с,
або
![]() кг/час.
кг/час.
