
Лабораторная работа № 3.
Физиология растительной клетки
Цель работы: ознакомление с важнейшими свойствами живой цитоплазмы - вязкостью, проницаемостью, гетерогенностью составляющих ее веществ. Показать роль клеточных структур и пограничных слоев цитоплазмы в процессе поступления воды и различных веществ в клетку. Получить представления о лабильности свойств цитоплазмы, их взаимосвязи и приспособительном значении.
Опыт 1. Изучение влияния катионов солей на вязкость цитоплазмы плазмолитическим методом
Теоретические основы исследования
Одним из важнейших показателей физико-химического состояния цитоплазмы является ее вязкость, так как она имеет большое приспособительное значение в жизни растений при изменении внешних факторов - температуры, водообеспеченности и т, д. Обезвоживание цитоплазмы естественным путем, например, при созревании семян или под действием концентрированных кислот и щелочей, увеличивает ее вязкость. Катионы кальция и алюминия, образуя дополнительные точки сцепления между отдельными молекулами белков цитоплазмы, повышают ее вязкость. Ионы калия увеличивают оводненность цитоплазмы, разжижая ее, снижают вязкость последней.
Вязкость цитоплазмы зависит также от видовых особенностей растения, характера экотипа, возраста органа и фазы онтогенеза растения. Она может быть различна в разных органах. В целом вязкость цитоплазмы тесно связана с жизнедеятельностью растений, поэтому она весьма лабильный показатель.
Имеется несколько методов определения вязкости цитоплазмы. Один из наиболее простых, наглядных способов - это определение ее вязкости по времени плазмолиза. Время плазмолиза - это промежуток времени от погружения клеток в гипертонический раствор до появления выпуклого плазмолиза более чем у половины клеток в поле зрения микроскопа. Время плазмолиза находится в прямой зависимости от вязкости цитоплазмы. Чем ниже вязкость цитоплазмы, тем легче она отстает от клеточной оболочки и переходит в вогнутый выпуклый плазмолиз, т. е. время плазмолиза меньше.
Цель исследования: установить влияние катионов (К+, Na+ и Са2+) на вязкость цитоплазмы на фоне сахарозы (контрольный вариант).
Материалы и оборудование: 1 М растворы сахарозы, KNO3, NaNO3; 0,7 М Ca(NO3)2; препаровальные иглы, стеклянные палочки, фильтровальная бумага, пинцеты, предметные и покровные стекла, микроскопы.
Растения: эпидермис лука (Allium sepa) или традесканции (Tradescantia discolor), или бегонии королевской (Begonia rex Putz), содержащих антоцианы, а также одновозрастные листья элодеи (Elodea canadensis), или мха мниум (Mnium splendens).
Схема исследования (опыта):
1.Эпидермис лука или другого растения в растворе сахарозы (контроль);
2. Эпидермис лука или другого растения в растворе KNO3 (вариант опыта);
3.Эпидермис лука или другого растения в растворе NaNO3;
4. Эпидермис лука или другого растения в растворе Ca(NO3)2
Ход работы:
Кусочек ткани исследуемого объекта поместить на предметное стекло в каплю воды и рассмотреть исходное состояние клеток. После этого исследуемый объект помещают в каплю растворов сахарозы и солей, согласно схеме исследования (в каждом варианте опыта берется новый эпидермис объекта исследования).
Отметить время погружения и через каждые 5 минут (4 раза) рассматривать объект в микроскоп и фиксировать степень (форму) плазмолиза (рис.1). Результаты исследования заносить в таблицу 1.
Таблица 1
Влияние катионов солей на время плазмолиза
Вари-ант опыта |
Плазмо-литики
|
Концентрация раствора в м/литр |
Время погружения ткани в раствор |
Время наступления плазмолиза в мин. |
Длитель-ность вогнутого плазмолиза |
|
вогнутого |
выпуклого |
|||||
1. |
Сахароза (контроль) |
1,0 |
|
|
|
|
2. |
KNO3 |
1,0 |
|
|
|
|
3. |
NaNO3 |
1,0 |
|
|
|
|
4. |
Ca(NO3)2 |
0,7 |
|
|
|
|
Если переход от вогнутого к выпуклому плазмолизу не происходит в течение длительного времени наблюдения (например, 20 мин), то отмечают, что время плазмолиза данного объекта больше 20 мин.
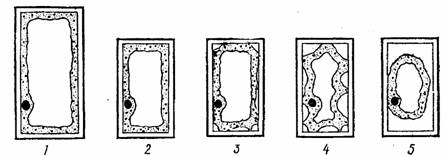
Рис 1. Последовательные стадии плазмолиза:
1 – тургесцентная клетка, 2 – общее сокращение объема клетки; 3 – уголковый плазмолиз, 4 – вогнутый плазмолиз, 5 –выпуклый плазмолиз
Опыт 2. Изучение прохождения одновалентных и двухвалентных катионов солей через структурные слои протопласта
Теоретические основы исследования
Протоплазма вакуолизированной растительной клетки при исследовании ее оптическими методами кажется однородной. В действительности же в ней установлено наличие трех слоев с различными свойствами: наружный - плазмалемма, внутренний, граничащий с вакуолей, - тонопласт и залегающая между ними толща плазмы - мезоплазма. В наличии указанных слоев плазмы можно убедиться, изучая поглощение веществ растительной клеткой.
Цель исследования: Установить проницаемость структурных слоев протопласта для одновалентных и двухвалентных катионов на основе колпачкового плазмолиза.
Материалы и оборудование: растворы: 1 М KNO3, 0,7 M Ca(NO3)2, эозина; препаровальные иглы, стеклянные палочки, предметные и покровные cтекла, микроскоп, сосуды на 5-10 мл.
Растения: эпидермис окрашенных растений (лука, традесканции и др.).
Схема исследования А:
1. Эпидермис растения (лука) в воде (контроль - исходная форма).
2. Эпидермис растения (лука) в 1 М КNОз
3. Эпидермис растения (лука) в 0,7 М Са(NОз)2
Ход работы:
В 5 – 10 мл стеклянные сосудики (бюксы или др.) наливают по 1-3 мл воды или раствор, согласно схеме исследования. Помещают в них плоскостные срезы эпидермиса выпуклой стороны чешуи окрашенного лука. Через 1-1,5 часа просматривают срез под микрокопом.
Вследствие того, что взятые растворы сильно гипертоничены, во всех клетках наблюдается сильный плазмолиз.
В одном из вариантов исследования со стороны поперечных стенок плазма имеет вид колпачков. Ядро также сильно увеличено. Увеличение объема плазмы и ядра - следствие набухания плазмы, которое вызвано прониканием катионов через плазмалемму в мезоплазму. Между тем через тонопласт эти катионы не проникают, о чем можно заключить по отсутствию увеличения объема вакуоли.
Следовательно, данный опыт доказывает различную проницаемость наружного и внутреннего пограничных слоев плазмы. Результаты наблюдения занесите в табл. 2.
Таблица 2
Проницаемость наружного и внутреннего пограничных слоев плазмы
Вариант опыта |
Концентрация раствора в м/литр |
Наличие колпачкового плазмолиза |
Увеличение |
||
мезоплазмы |
ядра |
вакуоли |
|||
1. вода |
1,0 |
|
|
|
|
2. KNO3 |
1,0 |
|
|
|
|
3. Сa(NO3)2 |
0,7 |
|
|
|
|
О непроницаемости тонопласта для определенных катионов можно наблюдать и на основе метода обнаружения тонопласта по де Фризу.
Схема исследования Б:
1. Срез эпидермиса бесцветного лука в капле эозина – индикатор - контроль;
2. Срез эпидермиса бесцветного лука в капле 1 М KNO3 + каплю эозина.
3. Срез эпидермиса бесцветного лука в капле 0,7 М Са(NОз)2 +каплю эозина.
Ход работы:
Эпидермис вогнутой (морфологически верхней) стороны чешуи бесцветного лука помещают на предметном стекле в каплю растворов, согласно схеме исследования Б. Через 3-5 мин начинают наблюдения под микроскопом. Хорошо заметно уменьшение объема вакуоли в одном из вариантов.
Вначале плазма окружает вакуоль тонким слоем, но очень быстро начинается набухание плазмы, а затем отмирание плазмы и ядра, вызванные действием катиона и эозина, которые проникли в мезоплазму. Участки отмершей плазмы, окрашенные в ярко-розовый цвет, хорошо заметны.
Так же, как в предыдущем опыте, в течение длительного времени вакуоля остается сокращенной и неокрашенной в розовый цвет. Следовательно, ни катион, ни эозин не проникают через тонопласт и вакуолю.
Результаты наблюдений заносятся в табл. 3.
Таблица 3
Проницаемость структур растительной клетки для катионов + эозин и эозина
Вариант исследования |
Окраска |
||
мезоплазмы |
ядра |
вакуоли |
|
1. Эозин |
|
|
|
2. Эозин + KNO3 |
|
|
|
3. Эозин + Сa(NO3)2 |
|
|
|
Анализируем полученные данные письменно в тетради и делаем выводы.
Опыт 3. Определение осмотического давления клеточного сока методом плазмолиза
Теоретические основы исследования
В природе широко распространено явление диффузии, т.е. тепловое движение частиц вещества из области его большей концентрации в область меньшей концентрации. При возникновении на пути диффундирующего вещества полупроницаемой мембраны движение вещества становится ограниченным, возникает односторонний ток воды через мембрану. Это явление называется осмосом. Чтобы воспрепятствовать поступлению растворителя через мембрану в раствор, надо приложить определенное давление, которое и называется осмотическим давлением, или потенциалом.
По Вант-Гоффу, осмотическое давление в случае разбавленных растворов подчиняется газовым законам. Поэтому для определения осмотического потенциала раствора можно применять формулу
P = RTCi, (1)
где P – осмотический потенциал, атм; R – газовая постоянная (0,082); T – абсолютная температура (273 + t°С); C – концентрация раствора, моли; i – изотонический коэффициент Вант-Гоффа, характеризующий степень диссоциации растворенного вещества.
Взрослая растительная клетка представляет собой осмотически активную систему, у которой роль полупроницаемой мембраны выполняет живая протоплазма, а осмотически активного раствора – клеточный сок вакуоли; поэтому каждая клетка обладает осмотическим потенциалом, который важен при водообмене растений.
Как видно из приведенной выше формулы, осмотическое давление можно рассчитать, зная концентрацию раствора C. Поэтому все методы определения осмотического давления сводятся к установлению равновесной концентрации раствора.
Принцип предлагаемого в настоящей работе метода основан на подборе концентрации наружного раствора, равной концентрации клеточного сока; ее находят по наблюдению степени плазмолиза, т. е. отставания содержимого клетки от клеточной оболочки.
