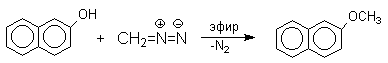- •1. Фенолы
- •1.1. Введение
- •2. Получение фенолов
- •2.1. Замещение сульфогруппы на гидроксил
- •2.2.Замещение галогена на гидроксил
- •2.3. Замещение диазогруппы на гидроксил
- •3. Свойства фенолов
- •3.1. Кислотные свойства фенолов
- •3.2. Таутомерия фенолов
- •3.4. Этерификация фенолов
- •3.5. Реакции электрофильного замещения в ароматическом кольце фенола
- •3.5.1. Галогенирование фенолов
- •3.5.2. Нитрование фенолов
- •3.5.3. Сульфирование фенолов
- •3.5.4. Нитрозирование фенолов
- •3.5.5. Алкилирование и ацилирование фенолов по Фриделю-Крафтсу
- •3.5.6. Формилирование фенолов
- •3.5.6А. Реакция Гаттермана
- •3.5.6Б. Реакция Вильсмейера-Хаака
- •3.5.6В. Реакция Реймера-Тимана
- •3.5.7. Конденсация фенолов с альдегидами и кетонами
- •3.5.8. Карбоксилирование феноксид-ионов - реакция Кольбе
- •3.5.9. Азосочетание
- •3.6. Перегруппировка Кляйзена аллилариловых эфиров
- •3.7. Окисление фенолов
3.2. Таутомерия фенолов
Естественно, что между амбидентными феноксид и енолят-ионами существует определенная аналогия. Фенол также является аналогом енола и между ним и его кето-формами (2,4- и 2,5-циклогексадиенами) должны существовать отношения, подобные тем, которые наблюдаются для равновесия кето- и енольной форм кетонов.
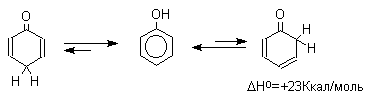
Для самого фенола энтальпия этого
равновесия составляет величину порядка
+23 Ккал/моль, что соответствует логарифму
константы равновесия в уравнении Гиббса
порядка 9,5
![]() 2,5,
т.е. равновесие целиком смещено в сторону
фенольной формы. Таким образом, соотношение
двух таутомерных форм здесь полностью
обратно тому, которое наблюдается для
кетонов, где преобладает кето-форма.
Это различие не удивительно, если принять
во внимание ароматическую стабилизацию
бензольного кольца фенола. Для других
одно- и двухатомных фенолов бензольного
ряда также не удается наблюдать
прототропную таутомерию. Для полициклических
конденсированных ароматических
соединений различие в термодинамической
устойчивости фенольной и диеноновой
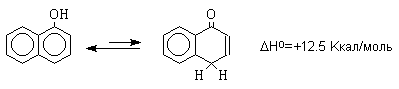
форм резко уменьшается, и для 1-нафтола
фенольная форма на 12,5 Ккал/моль стабильнее
диенона, тогда как для 9-гидроксиантрацена
кетоформа антрона уже оказывается
термодинамически более стабильной
формой.
2,5,
т.е. равновесие целиком смещено в сторону
фенольной формы. Таким образом, соотношение
двух таутомерных форм здесь полностью
обратно тому, которое наблюдается для
кетонов, где преобладает кето-форма.
Это различие не удивительно, если принять
во внимание ароматическую стабилизацию
бензольного кольца фенола. Для других
одно- и двухатомных фенолов бензольного
ряда также не удается наблюдать
прототропную таутомерию. Для полициклических
конденсированных ароматических
соединений различие в термодинамической
устойчивости фенольной и диеноновой
форм резко уменьшается, и для 1-нафтола
фенольная форма на 12,5 Ккал/моль стабильнее
диенона, тогда как для 9-гидроксиантрацена
кетоформа антрона уже оказывается
термодинамически более стабильной
формой.
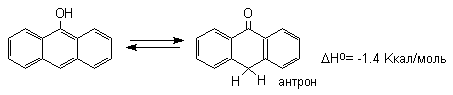
Для 9-гидроксиантрацена известны обе формы, причем в неполярных растворителях (петролейный эфир, бензол, ССl4) равновесие сдвинуто в сторону антрона (К20=400 в бензоле). Устойчивость таутомерных кето-форм возрастает при переходе к полиатомным фенолам. Так, при плавлении 1,4-дигидроксинафталина получается равновесная смесь, содержащая 10%-дикетоформы.
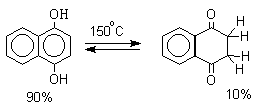
Длительное время не предпринималось попыток фиксации или стабилизации кето-формы фенолов ряда бензола и нафталина и проблема таутомерии фенолов не привлекала внимания исследователей. В 1968 году В.А.Коптюг с сотрудниками предложил простой и чрезвычайно эффективный способ стабилизации кето-формы разнообразных фенолов с помощью сильных кислот Льюиса- хлорида или бромида алюминия. Эти жесткие кислоты Льюиса связывают жесткий карбонильный кислород кето-формы в очень стабильный комплекс, который может быть зафиксирован с помощью ПМР- и ИК-спектроскопии. При этом для 1-нафтола, 2-нафтола и фенолов бензольного ряда, содержащих хотя бы одну алкильную группу в мета-положении к гидроксилу, равновесие в неполярной среде нацело смещается в сторону кето-формы.



Эти комплексы можно рассматривать также как биполярные ионы, т.е. как гидроксиаренониевые ионы, образующиеся при протонировании фенолов по бензольному кольцу. Для них должны быть характерны реакции, типичные для аренониевых ионов. Действительно, комплекс 2-нафтола с хлоридом алюминия может быть использован в качестве электрофильного агента в электрофильном ароматическом замещении в бензольном кольце.
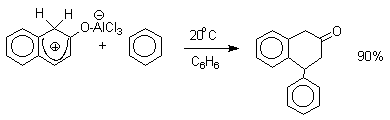
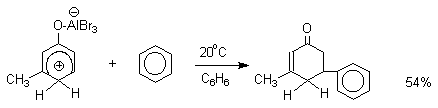
Аналогично реагирует и комплекс мета-крезола с AlBr3.
Кето-енольная таутомерия лежит в основе
замещения фенольного гидроксила на
аминогруппу, которое происходит при
нагревании 1- или 2-гидроксинафталина,
сульфопроизводных
![]() -
и
-
и
![]() -нафтолов,
6- или 8-гидроксихинолинов и других
гидроксипроизводных нафталина, антрацена,
хинолина с водным раствором сульфита
или гидросульфита аммония при 130-150оС.
-нафтолов,
6- или 8-гидроксихинолинов и других
гидроксипроизводных нафталина, антрацена,
хинолина с водным раствором сульфита
или гидросульфита аммония при 130-150оС.

Эта реакция, открытая Г.Бухерером в 1904 году, применима к одноатомным фенолам ряда нафталина, антрацена и других конденсированных ароматических систем, но в нее практически не вступают одноатомные фенолы бензольного ряда.
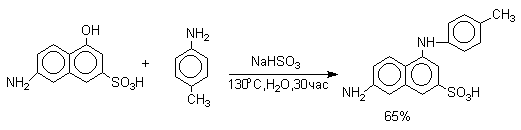
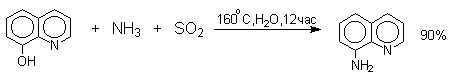
В ряду производных бензола в реакцию вступают многоатомные фенолы, содержащие две или три гидроксильные группы в мета-положении к друг другу:

Для реакции Бухерера предложен, но строго не доказан механизм, в котором сульфит- или гидросульфит-ион присоединяется в -положение кето-формы нафтола с образованием -кетосульфокислоты в качестве интермедиата, который в отдельных случаях был выделен в индивидуальном виде.
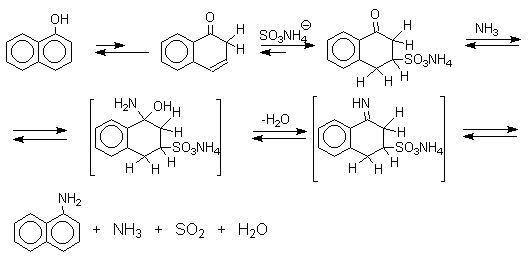
Последующее аминирование и отщепление сернистой кислоты приводит к амину. Реакция обратима и при обработке 1- или 2-амино-нафталина и их производных гидросульфитом натрия в воде при 130-150оС они превращаются в соответствующие фенолы, например:
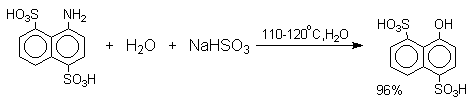
3.3. С- и О-Алкилирование амбидентных фенолят-ионов
Феноксид-ионы, как типичные амбидентные анионы, способны к реакциям О- и С-алкилирования. В большинстве случаев феноксид-ионы подвергаются региоселективному О-алкилированию независимо от природы радикала и уходящей группы алкилирующего агента. Самые разнообразные жесткие и мягкие алкилирующие агенты дают эфиры фенолов в реакциях со щелочными фенолятами. Наилучшие результаты для О-алкилирования достигаются в диполярных апротонных растворителях, хорошо сольватирующих катионы щелочных металлов.

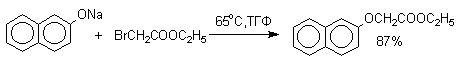
Если же растворитель избирательно сольватирует кислородный центр феноксид-иона, открывается возможность для С-алкилирования. Кислородный центр феноксид-ионов подвергается избирательной сольватации с помощью водородной связи в воде, трифторэтаноле, феноле. В этих растворителях удается осуществить С-алкилирование феноксид-иона под действием таких мягких алкилирующих агентов, как аллилгалогениды и бензилгалогениды.


Кислородный центр аниона блокируется в результате избирательной сольватации и алкилирующий агент атакует другой нуклеофильный центр амбидентного аниона - атом углерода в орто-положении по отношению к атому кислорода. Аналогичный результат может быть достигнут за счет блокирования кислородного центра противоионом в сложном ассоциате ионных пар щелочных фенолятов и нафтолятов. Действительно, при алкилированиии фенолята натрия в бензоле аллилбромидом образуется 2-аллилфенол, тогда как в ацетоне в тех же условиях получается только аллиловый эфир фенола.
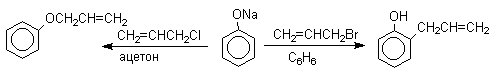
По той же причине алюминиевые соли фенолов подвергаются С-алкилированию в орто-положение бензольного кольца.
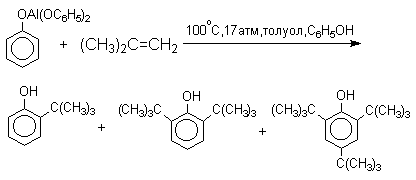
Эта реакция имеет практическое значение для синтеза стерически затрудненных фенолов, используемых в качестве стабилизаторов полимеров против термоокислительной деструкции. Фенолы, подобно карбоновым кислотам, подвергаются селективному О-метилированию при действии диазометана в эфирном растворе. Напомним, что спирты реагируют с диазометаном только в присутстсвии катализаторов - кислот Льюиса.