
4 Примеры расчетов
4.1 Составить материальный и тепловой балансы сжигания сероводорода для сернокислотного завода производительностью 10 т/ч моногидрата. Исходный газ содержит 90% Н2S, 5% Н2О и % (об.) N2. На 1 м3 сероводородного газа в печь подается 10 м3 воздуха (в пересчете на сухой); содержание влаги в воздухе 1% (об.). Температура поступающего воздуха и сероводородного газа 200С.
Решение.
Производим материальный расчет. Количество 100%-ного сероводородного газа, которое необходимо сжечь в печи:
10000 · 22.4/98 = 2290 м3/ч.
С учетом производственных потерь (5%), необходимо подать в печь, м3/ч:
100%-ного Н2S 2290/0.95 = 2410
или 90%-ного сероводородного газа 2290 /(0.9 · 0.95) = 2680
Количество сухого воздуха, подаваемого в печь: 2680 · 10 = 26800 м3/ч
С воздухом войдет в печь водяных паров: (2680 · 0.01) /0.00 = 270 м3/ч.
Кроме того, с воздухом поступит, м3/ч:
О2……………………………26800 · 0.21 = 5600
N2…………………………….26800 · 0.79 = 21200
На сжигание сероводорода согласно реакции:
Н2S + 1.5О2 = SО2 + Н2О
израсходуется кислорода: 2680 · 0.9 · 1.5 = 3630 м3/ч
При этом образуется по 2410 м3/ч сернистого ангидрида и водяных паров.
Количество и состав обжигового газа:
м3/ч %об.
SО2 ………………………………….2410 8.45
О2…… ………………. 5600 – 3630 = 1970 6.9
Н2О……….2680 · 0.05 +2410 + 270 = 2814 9.85
N2…………….21200 + 2680 · 0.05 = 21334 74.8

Всего…………………………..28 528 100
Составляем материальный баланс сжигания сероводорода:
Приход |
м3/ч |
кг/ч |
Расход |
м3/ч |
кг/ч |
Сероводородный газ: Н2S Н2О N2 Воздух: О2 N2 Н2О Всего: |
2410 135 135
5600 21200 270 |
3660 107 167
8000 26400 216 38550 |
Печной газ: SО2 О2 Н2О N2
Всего |
2410 1970 2814 21334 |
6900 2810 2260 26500
38470 |
Невязка баланса:
(38550 – 38470)/38500 · 100 = 0.2%
Определим статьи теплового баланса.
Приход теплоты
За счет поступающего сероводородного газа (условно считаем, что газ содержит только Н2S):
2680 · 1.47 · 20 = 78800 кДж/ч
где 1.47 – теплоемкость сероводорода, отнесенная к 1 м3 газа при нормальных условиях, кДж/(м3 *К).
Теплота, вносимая воздухом:
(26800 +270) · 1.34 · 20 = 725500 кДж/ч
где 1.34 – теплоемкость воздуха, (ввиду малого содержания влаги в воздухе различием теплоемкости водяного пара и сухого воздуха пренебрегаем) кДж/(м3·К).
При сжигании сероводорода выделится
(2410 · 519.3 · 1000) /22.4 = 55871000 кДж/ч
где 519.3 кДж – теплота сгорания 1 моль Н2S.
Общее количество поступившей теплоты:
Qприх = 78800 + 725500 + 55871000 = 55675300 кДж/ч
Расход теплоты
За счет теплопотерь из печи в окружающее пространство, принимаем равными 20% от прихода теплоты, уходит:
55675300 · 0.2 = 11135000 кДж/ч
Теплота, уносимая обжиговым газом, равна разности между приходом тепла и теплопотерями:
55675300 – 11350000 = 44325300 кДж/ч
Принимая среднюю теплоемкость обжигового газа 1.38 кДж/(м3 *К), определим температуру газа, уходящего из печи:
T = 44325300/1.38 · 28528 = 11260С.
Составляем часовой тепловой баланс сжигания сероводорода
Приход |
кДж |
Расход |
кДж |
с сероводородным газом с воздухом теплота реакции Всего: |
78800 725500 55871000 55675300 |
Теплопотери с печным газом
Всего: |
11135000 44325300
55675300 |
4.2 Составить материальный и тепловой балансы процесса нейтрализации азотной кислоты аммиаком в аппарате ИТН. Составление материального баланса необходимо для определения расходных коэффициентов исходных реагентов и для подсчета размеров реакционной и вспомогательной аппаратуры. Тепловой баланс нейтрализатора позволяет проверить возможность получения раствора аммиачной селитры заданной концентрации.
Материальный баланс
Расчет ведется на 1000 кг 100% NН4NО3.
Принимаем концентрацию азотной кислоты 48% НNО3, аммиака 97% NН3, получаемого раствора 66% NН4NО3; потери аммиака на всех стадиях производства 0.3%, азотной кислоты 0.75% от выхода NН4NО3.
Согласно реакции NН3(газ) + НNО3(жидк) = NН4NО3(тв) + 145.8 кДж, теоретический расход 100% НNО3:
63 · 1000/80 = 787.5 кг
100% NН3:
17 · 1000/80 = 212.5 кг
где 63, 17, 80 – масса 1 моль соответственно НNО3, NН3, и NН4NО3.
Расход 100% НNО3 с учетом потерь:
787.5 + (0.75 · 1000/100) = 795.0 кг
или в пересчете на 48% НNО3:
795 · 100/48 = 1656.0 кг
Расход 100 % NН3 с учетом потерь:
212.5 + (0.3 · 1000/100) = 215.5 кг
или в пересчете на 97% газообразный аммиак:
212.5 · 100/97 = 222.0 кг.
Содержание инертных газов в аммиаке:
222.0 – 215.5 = 6.5 кг.
Вся вводимая азотная кислота нейтрализуется аммиаком. Определяем массу образующейся 100% NН4NО3:
795 · 80/63 = 1009.7 кг
Масса 66% раствора аммиачной селитры, полученного в нейтрализаторе (включая потери раствора):
1009.7 · 100/66 = 1529.8 кг
или за вычетом потерь раствора:
1000 · 100/66 = 1515.1 кг
потери 66% раствора аммиачной селитры:
1529.8 – 1515.1 = 14.7 кг.
На образование 1009.7 кг NН4NО3 расходуется 100% NН3:
1009.7 · 17/80 = 214.5 кг.
Отсюда потери 100% NН3 с соковым паром равны:
215.5 – 214,5 = 1.0 кг.
Выход сокового пара (включая инертные газы и потери газообразного аммиака):
1656.0 + 222.0 – 1529.8 = 348.2 кг.
В том числе содержание собственно водяного пара:
348.2 – (6.5 + 1.0) = 340.7 кг.
Полученные результаты сведем в таблицу.
Таким образом, на 1 т аммиачной селитры (100% NН4NО3) расходуется 0.215 т газообразного аммиака (100% NН3) и 0.795 т азотной кислоты (100% НNО3).
Материальный баланс процесса нейтрализации (на 1 т NН4NО3)
Приход |
кг |
Расход |
кг |
48% НNО3 в том числе 100% НNО3 вода Аммиак газообразный 97% в том числе 100% NН3 Инертные газы |
1656.0 795.0 861.0
222.0 215.5 6.5 |
Раствор аммиачной селитры (66%) в том числе 100% NН4NО3 вода Потери раствора NН4NО3 в том числе 100% NН4NО3 вода Выход сокового пара в том числе водяной пар 100% NН3 инертные газы |
1515.1 1000.0 515.1 14.7 9.7 5.0 348.2 340.7 1.0 6.5 |
Итого |
1878.0 |
Итого |
1878.0 |
Тепловой баланс
Расчет ведется на 1000кг NН4NО3.
Приняты следующие исходные показатели:
Начальная температура, 0С
азотной кислоты………………………………………………………….30
аммиака……………………………………………………………………50
Давление аппарате ИТН, кПа………………………………………….120
Температура 66% раствора NН4NО3 на выходе из аппарата ИТН, 0С 122
Приход тепла
Физическое тепло 48% азотной кислоты:
1656 · 2.91 · 30 = 144069 кДж
где 2.91 кДж/(кг·К) – теплоемкость 48% НNО3.
Физическое тепло газообразного аммиака:
222 · 2.19 · 50 = 24309 кДж,
где 2.19 кДж/(кг·К) – теплоемкость газообразного аммиака.
Тепловой эффект реакции определяется по номограмме. Количество тепла, выделяющегося при нейтрализации 48% НNО3 равна 1486 кДж/кг (кривая 1). Теплота растворения NН4NО3 при получении 66% раствора составляет 184 кДж/кг (кривая 2).
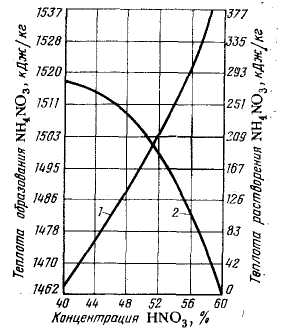
Рисунок 1. Диаграмма для определения суммарного теплового эффекта (разность значений на кривых 1 и 2) нейтрализации растворов HNO3 аммиаком при 18 0С (данные Я. И. Кильмана): 1 — теплота реакции NН3(газ) + HNО3 (жидк.) = NH4NO3(тв.) с учетом теплоты разбавления азотной кислоты водой; 2 — теплота растворения NH4NO3 в воде.
Суммарный тепловой эффект процесса нейтрализации в заданных условиях:
1486 – 184 =1302 кДж/кг
Количество тепла, выделяющегося при образовании 1009.7 кг NН4NО3:
1009.7 · 1302 = 1314629 кДж
Общий приход тепла в нейтрализаторе:
144069 + 24309 + 1314629 = 1483007 кДж
Расход тепла
Количество тепла, уносимого раствором NН4NО3 из нейтрализатора:
1529.8 · 2.47 · 122 = 460990 кДж
где 2 .47 кДж/ (кг·К) – теплоемкость 66% раствора NН4NО3
Расход тепла на образование сокового пара в нейтрализаторе:
2682.6 · 340.7 = 913962 кДж
где 2682.6 кДж/кг – энтальпия насыщенного водяного пара при абсолютном давлении 120 кПа.
Количество тепла, уносимого из нейтрализатора инертными газами, относим к тепловым потерям аппарат в окружающую среду.
Общее количество уносимого тепла:
460990 + 913962 = 1374952 кДж
Разность между приходом и расходом тепла составляет:
1483007 – 1374952 = 108055 кДж
или по отношению к приходу тепла:
108055 · 100/1483007 = 7.3%
Подсчитанная разность между приходом и расходом тепла (7.3%) может быть отнесена на тепловые потери в окружающую среду.
Полученные результаты сведем в таблицу.
Тепловой баланс процесса нейтрализации (на 1 т NН4NО3)
Приход |
кДж |
Расход |
кДж |
Физическое тепло 48% НNО3 Физическое тепло газообразного аммиака Тепло образования NН4NО3 |
144069
24309
1314629 |
Тепло, уносимое 66% раствором аммиачной селитры Тепло образования сокового пара Разность между приходом и расходом тепла |
460990
913962
108055 |
Итого |
1483007 |
Итого |
1483007 |
Результаты расчета показывают, что образование 66% раствора аммиачной селитры в заданных условиях возможно. Из теплового баланса процесса нейтрализации видно, что основное количество тепла (88.7%) поступает за счет теплового эффекта реакции. Наибольшее количество поступающего тепла (61.6%) тратится на парообразование (концентрирование раствора) непосредственно в аппарате –нейтрализаторе.
Содержание:
Введение 3
1 Содержание и объем курсовой работы 4
2 Задание 4
3 Методические указания к выполнению курсовой работы 4
Типовая таблица материального баланса 5
Расход 5
Статья прихода 5
Статья расхода 5
Количество, кг 5
Продукт А 5
Продукт В 5
Продукт С 5
Итого 5
G 5
Итого 5
4 Примеры расчетов 8
