
- •Методические указания
- •394026 Воронеж, Московский просп.,14
- •1. Определение коэффициента внутреннего трения воздуха при различных температурах (Лабораторная работа № 1.16)
- •1.1. Теоретическое введение
- •1.2. Методика измерения коэффициента внутреннего трения
- •1.3. Описание экспериментальной установки
- •Двухканальный измеритель 2трмо
- •1.4. Выполнение работы
- •3. Определение удельной теплоёмкости воздуха при постоянном давлении (Лабораторная работа № 1.17)
- •3.1. Экспериментальная установка и методика измерений
- •1. При работе на мультиметре необходимо пользоваться оригинальными щупами.
- •2. Когда мультиметр подключён к проверяемой цепи, не дотрагиваетесь до неиспользуемых гнёзд.
- •3. Перед тем, как повернуть переключатель пределов для смены рода работы, отключите щупы от проверяемой цепи.
- •3.2. Порядок проведения эксперимента
- •3.3. Измеренные и расчётные величины
- •3.4. Данные установки и таблица результатов эксперимента
- •4.1. Лабораторная работа № 1.18, а
- •4.1.2. Порядок выполнения работы
- •4.2. Лабораторная работа № 1.18,б
- •4.2.1. Методика измерений и вывод рабочей формулы
- •4.2.2. Описание эксперимента
- •Установка работает следующим образом
- •Измеряемые величины:
- •4.2.3. Порядок выполнения работы
- •Обработка результатов
- •5. Определение удельной теплоты кристаллизации и изменения энтропии при охлаждении олова (Лабораторная работа №1.19)
- •5.1. Теоретические основы работы
- •5.2. Описание экспериментальной установки
- •5 15 14 .3. Порядок выполнения работы
- •5.4. Обработка результатов измерений
- •Измерений
- •Порядок проведения эксперимента и обработка полученных данных
- •Проведение измерений.
- •Библиографический список
- •Содержание
Обработка результатов
Вычислить Н = H1-Н2.
Вычислить h = h1-h2.
Определить γ = 1 / (1- h/H).
Сравнить результат эксперимента с табличными данными, определить расхождение в процентах.
Таблица
-
№ оп.
H1,
мм
H2,
мм
Н,
мм
h1,
мм
h2,
мм
h,
мм
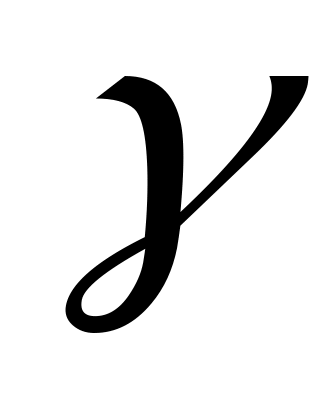
5. Определение удельной теплоты кристаллизации и изменения энтропии при охлаждении олова (Лабораторная работа №1.19)
Цель работы: определение изменения энтропии при фазовом переходе первого рода на примере кристаллизации олова из расплава при его охлаждении. Определение теплоты кристаллизации олова из закона сохранения энергии.
5.1. Теоретические основы работы
Кристаллизация процесс перехода вещества из жидкого состояния в твердое. Процесс кристаллизации связан с выделением количества теплоты, равного теплоте плавления. Для химически чистых веществ процесс кристаллизации протекает при постоянной температуре, равной температуре плавления.
Количество теплоты, которое
необходимо отвести от единицы массы
жидкости при температуре кристаллизации
для перехода жидкости в твердое состояние,
называется удельной теплотой
кристаллизации кр.
Из первого начала термодинамики
![]() следует
следует
![]() , (6.1)
, (6.1)
где, Uтв, Uж внутренняя энергия единицы массы в твердом и жидком состоянии; Vтв, Vж удельный объем твердой и жидкой фазы соответственно; p давление в процессе кристаллизации.
Поскольку при переходе из жидкого в
твердое состояние объем олова практически
не меняется, имеем
![]() .
В этом случае
.
В этом случае
![]() .
(6.2)
.
(6.2)
Энтропия функция состояния термодинамической системы. Изменение энтропии в равновесном процессе равно отношению количества теплоты, сообщенного системе, к термодинамической температуре системы:
![]() .
.
Энтропия определяется с точностью до постоянной. Разность энтропий в двух состояниях при обратимом процессе равна
![]() ,
(6.3)
,
(6.3)
где Q элементарное количество теплоты, полученное или отданное при бесконечно малом изменении параметров термодинамической системы; Т температура.
В процессе кристаллизации олово отдает тепло окружающей среде при Т=const. При этом количество теплоты, отданное окружающей среде
![]() .
(6.4)
.
(6.4)
Здесь М0 масса олова. Так как Q количество теплоты, отданное окружающей среде, то Q<0.
Из (3) и(4) следует, что
![]()
или
![]() .
(6.5)
.
(6.5)
В процессе кристаллизации происходит упорядочивание структуры вещества, внутренняя энергия вещества уменьшается, что приводит к убыванию энтропии системы.
Простейшей моделью охлаждения тела является охлаждение в среде с постоянной температурой Тср (в термостате). Если процесс охлаждения происходит достаточно медленно, температуру произвольной точки тела в каждый момент времени можно считать одинаковой. Такой процесс охлаждения состоит из непрерывно следующих друг за другом равновесных состояний и, следовательно, является квазистатическим обратимым процессом.
Применим закон сохранения энергии к квазистатическому процессу охлаждения твердого олова после кристаллизации:
![]() . (6.6)
. (6.6)
Здесь
![]() количество теплоты,
отданное телом среде при его охлаждении
за время d;
количество теплоты,
отданное телом среде при его охлаждении
за время d;
![]() количество теплоты,
полученное окружающей средой через
поверхность ампулы площадью F
за время d.
количество теплоты,
полученное окружающей средой через
поверхность ампулы площадью F
за время d.
В (6.6) с0, са удельные теплоемкости олова и материалы ампулы, М0, Ма массы олова и ампулы; Т температура твердого олова; Тср температура окружающей среды; коэффициент теплоотдачи с поверхности ампулы в окружающую среду. В дальнейшем считаем, что значение в течение всего опыта постоянно.
Решение этого уравнения имеет вид
![]() ,
(6.7)
,
(6.7)
где
![]() ;
;
![]() ;
;
![]() .
.
Коэффициент m называют темпом охлаждения. Он характеризует относительную скорость изменения температуры тела. Темп охлаждения можно определить из линейной зависимости, полученной логарифмированием функции (6.7):
![]() , (6.8)
, (6.8)
откуда n
![]() .
(6.9)
.
(6.9)
Применяя теперь закон сохранения энергии к процессу кристаллизации олова, можно получить уравнение
![]() . (6.10)
. (6.10)
Здесь
количество теплоты,
отданное оловом при его кристаллизации
за время кристаллизации
![]() .
.
Так как тепло отдано окружающей
среде, то Q<0. Второй член
суммы в (6.10):
![]() количество теплоты,
полученное окружающей средой через
поверхность ампулы за время кристаллизации.
количество теплоты,
полученное окружающей средой через
поверхность ампулы за время кристаллизации.
Из соотношений (6.9), (6.10) и (6.5) находим окончательно
![]() ,
(6.11)
,
(6.11)
![]() . (6.12)
. (6.12)
Реальный процесс охлаждения сопровождается явлениями, вносящими погрешность в определение кр. Главными источниками погрешности являются:
отклонение процесса охлаждения от квази- статического;
изменения температуры окружающей среды.
Эти процессы приводят к методической погрешности определения кр, не превышающей 10%.
