
- •18. Круговые процессы: основные понятия и определения. Коэффициенты, определяющие эффективность круговых процессов.
- •19. Прямой цикл Карно и его исследование. Значение цикла Карно.
- •20. Обратный цикл Карно и его исследование.
- •21. Регенеративный цикл Карно; кпд цикла, условия его построения.
- •22. Основные формулировки второго закона термодинамики. Вывод второго закона термодинамики (принцип возрастания энтропии).
- •23. Вывод дифференциального уравнения второго закона термодинамики. (Принцип существования энтропии).
22. Основные формулировки второго закона термодинамики. Вывод второго закона термодинамики (принцип возрастания энтропии).
Второй закон связан с понятием энтропии, являющейся мерой хаоса (или мерой порядка). Второй закон термодинамики гласит, что для вселенной в целом энтропия возрастает.
Существует два классических определения второго закона термодинамики :
Кельвина и Планка
Не существует циклического процесса, который извлекает количество теплоты из резервуара при определенной температуре и полностью превращает эту теплоту в работу. (Невозможно построить периодически действующую машину, которая не производит ничего другого, кроме поднятия груза и охлаждения резервуара теплоты)
Клаузиуса
Не существует процесса, единственным результатом которого является передача количества теплоты от менее нагретого тела к более нагретому. (Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара)
Оба определения второго закона термодинамики опираются на первый закон термодинамики, утверждающий, что энергия убывает.
Второй закон связан с понятием энтропии (S).
Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается.
Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
100% энергии не может быть преобразовано в работу
Энтропия может вырабатываться, но не может быть уничтожена
Всякие естественные процессы сопровождаются возрастанием энтропии Вселенной; такое утверждение часто называют принципом энтропии. Также энтропия характеризует условия, при которых запасается энергия: если энергия запасается при высокой температуре, ее энтропия относительно низка, а качество, напротив, высоко. С другой стороны, если то же количество энергии запасается при низкой температуре, то энтропия, связанная с этой энергией, велика, а ее качество - низко.
Возрастание энтропии является характерным признаком естественных процессов и соответствует запасанию энергии при более низких температурах. Аналогично можно сказать, что естественное направление процессов изменения характеризуется понижением качества энергии.
Такое истолкование связи энергии и энтропии, при котором энтропия характеризует условия запасания и хранения энергии, имеет большое практическое значение. Первое начало термодинамики утверждает, что энергия изолированной системы (а возможно, и всей Вселенной) остается постоянной. Поэтому, сжигая ископаемое топливо - уголь, нефть, уран - мы не уменьшаем общих запасов энергии. В этом смысле энергетический кризис вообще невозможен, так как энергия в мире всегда будет оставаться неизменной. Однако, сжигая горсть угля и каплю нефти, мы увеличиваем энтропию мира, поскольку все названные процессы протекают самопроизвольно. Любое действие приводит к понижению качества энергии Вселенной. Поскольку в промышленно развитом обществе процесс использования ресурсов стремительно ускоряется, то энтропия Вселенной неуклонно возрастает. Нужно стремиться направить развитие цивилизации по пути снижения уровня производства энтропии и сохранения качества энергии.
Принцип возрастания энтропии сводится к утверждению, что энтропия изолированных систем неизменно возрастает при всяком изменении их состояния и остается постоянной лишь при обратимом течении процессов: Оба вывода о существовании и возрастании энтропии получаются на основе какого-либо постулата, отражающего необратимость реальных процессов в природе. Наиболее часто в доказательстве объединенного принципа существования и возрастания энтропии используют постулаты Р.Клаузиуса, В.Томпсона-Кельвина, М.Планка.
В действительности принципы существования и возрастания энтропии ничего общего не имеют. Физическое содержание: принцип существования энтропии характеризует термодинамические свойства систем, а принцип возрастания энтропии - наиболее вероятное течение реальных процессов. Математическое выражение принципа существования энтропии - равенство, а принципа возрастания - неравенство. Области применения: принцип существования энтропии и вытекающие из него следствия используют для изучения физических свойств веществ, а принцип возрастания энтропии - для суждения о наиболее вероятном течении физических явлений. Философское значение этих принципов также различно.
В связи с этим принципы существования и возрастания энтропии рассматриваются раздельно и математические выражения их для любых тел получаются на базе различных постулатов.
Вывод о существовании абсолютной температуры T и энтропии s как термодинамических функций состояния любых тел и систем составляет основное содержание второго закона термодинамики и распространяется на любые процессы - обратимые и необратимые.
Для обратимого цикла Карно можем записать:
![]() .
.
Отсюда следует:
![]() или
или ![]() .
.
Величина Q2 – количество теплоты, отдаваемой рабочим телом, имеет знак минус, поэтому
![]() или
или ![]() .
.
Отношение ![]() называется
приведённой теплотой, и полученное
выражение можно прокомментировать так:
в обратимом цикле Карно сумма приведенных
теплот равна нулю.
называется
приведённой теплотой, и полученное
выражение можно прокомментировать так:
в обратимом цикле Карно сумма приведенных
теплот равна нулю.
М ожно
показать, что равенство нулю приведённой
теплоты будет выполняться для любого
обратимого цикла.
ожно
показать, что равенство нулю приведённой
теплоты будет выполняться для любого
обратимого цикла.
Рис. 5
Представим произвольный цикл состоящим из множества элементарных циклов Карно (рис.5). Изотермические участки подвода и отвода теплоты пересекают контур нашего цикла. В предельном случае, когда циклов Карно бесконечно много, изотермические участки подвода и отвода теплоты в точности повторят контур произвольного цикла. Тогда можно записать:
![]() или
при
или
при ![]()
![]() .
.
Полученное выражение называют первым интегралом Клаузиуса.
Р ис.
6
ис.
6
В необратимом цикле Карно (рис. 6) при тех же температурах нагревателя и холодильника, что и в обратимом цикле, цикловая работа, а следовательно и термический КПД, оказываются меньше, чем у обратимого цикла:
![]() .
.
Тогда
![]() или
или ![]() .
.
Учитывая знак Q2, приходим к неравенству
![]() .
.
В пределе для всех необратимых циклов
![]() .
.
Выражение называют вторым интегралом Клаузиуса. В общем случае для любых циклов можно записать:
![]() ,
,
здесь знак равенства относится к обратимым циклам, а неравенства – к необратимым.
Из
математики известно, что если интеграл
по замкнутому контуру равен нулю, то
подынтегральное выражение представляет
собой полный дифференциал некоторой
функции. Следовательно, ![]() есть
полный дифференциал функции, которая
в термодинамике получила название энтропии:
есть
полный дифференциал функции, которая
в термодинамике получила название энтропии:
![]() .
.
Удельная энтропия:
![]() .
.
Так как энтропия имеет полный дифференциал, она является параметром состояния, т.е. её изменение в термодинамическом процессе равно разности значений функции в начальном и конечном состояниях и не зависит от вида процесса. Рассмотрим обратимый цикл, состоящий их 2-х процессов:
Р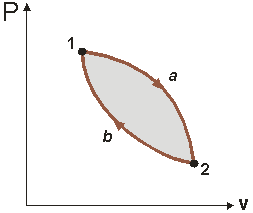 ис.
7
ис.
7
Для него можно записать:
или представляя интеграл в виде суммы
![]() .
.
Меняя пределы интегрирования во втором интеграле, получаем:
![]() или
или ![]() .
.
Независимо от пути перехода из одного состояния в другое значение интеграла одинаково, следовательно, подынтегральная функция представляет собой функцию состояния.
Если один из процессов необратим, например, 1а2, то интеграл будет отрицательным, и мы получим в итоге:
![]()
То есть, для необратимого процесса значение интеграла меньше, чем изменение энтропии:
![]() .
.
Для
замкнутых систем (т.е. предоставленных
самим себе) и адиабатно изолированных
от окружающей среды (![]() ):
):
![]() .
.
Следовательно,
для обратимых процессов ![]() и
и ![]() ,
а для необратимых
,
а для необратимых ![]() и
и ![]() ,
т.е. энтропия увеличивается.
,
т.е. энтропия увеличивается.
Выражение ![]() представляет
собой математическую формулировку
второго закона термодинамики. Это
выражение можно объединить с первым
законом термодинамики и
получить термодинамические
тождества:
представляет
собой математическую формулировку
второго закона термодинамики. Это
выражение можно объединить с первым
законом термодинамики и
получить термодинамические
тождества:
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
По аналогии с работой расширения-сжатия, количество теплоты можно определить графически на термодинамической T-S диаграмме. Количество теплоты определяется в виде определенного интеграла
![]()
и представляет собой площадь под линией процесса (рис. 8).
 Рис.
8
Рис.
8
В связи с этим T-S диаграмму называют тепловой диаграммой.
Так как абсолютная температура всегда положительна:
![]() -
тепло подводится, процессы идут вправо;
-
тепло подводится, процессы идут вправо;
![]() -
тепло отводится, процессы идут влево.
-
тепло отводится, процессы идут влево.
