
Исключения из правила Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au[1] имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами 4f орбиталей, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Электронные формулы атомов химических элементов |
Свойства электронов и других микрообъектов таковы, что для их описания оказываются недостаточным законы Ньютона, на которых основывается классическая механика и которые применимы лишь к макроскопическим телам. В частности, вместо точных координат можно говорить лишь о вероятности нахождения электрона в какой–либо точке около ядра атома. В связи с этим электрон в атоме удобно описывать как целое облако отрицательного заряда («электронное облако»), причем плотность этого облака в какой-то точке пропорциональна вероятности нахождения в ней электрона. Изображая электронное облако на рисунке, имеют в виду, что изображается условная поверхность, ограничивающая область, в которой сосредоточена большая часть (скажем, 95%) электронного облака, плотность которого хотя и очень быстро, но все же постепенно убывает по мере удаления от ядра. Электроны в атоме располагаются по энергетическим уровням (первый, второй, третий и т.д.), которые, в свою очередь, состоят из подуровней, обозначаемых латинскими буквами (s, p, d и f – подуровней). Максимальное число электронов на каждом уровне равно 2n2, где n – порядковый номер уровня. Таким образом, на первом уровне не может быть больше двух электронов, а втором – не больше 8, на третьем – 18 и на четвертом – 32. По ряду причин, рассмотрение которых выходит за рамки школьного курса, максимальное число электронов на данном уровне достигается не всегда, поэтому экспериментально наблюдается не более 32 электронов на всех уровнях, начиная с четвертого. На первом уровне могут находиться только s-электроны. Так как электронное облако s-электрона имеет сферическую симметрию, оно может быть ориентировано относительно трех координатных осей одним единственным способом; в таком случае говорят, что имеется одна s-орбиталь, на которой могут поместиться два электрона, отличающиеся знаком собственного магнитного момента («спин»). На втором и последующих уровнях, помимо s-подуровня, есть еще p-подуровень. Электронное облако p-электрона имеет осевую симметрию, поэтому возможны три ориентации p-облаков вдоль трех координатных осей, что соответствует трем p-орбиталям. Поскольку одна орбиталь может вмещать два электрона, на каждом p- подуровне может находиться не больше 6 электронов. На третьем и последующих уровнях помимо s- и p-подуровней имеется еще d-подуровень. вмещающий 10 электронов, располагающихся на пяти d-орбиталях. На четвертом и последующих уровнях есть помимо перечисленных выше еще и f-подуровни, вмещающий 14 электронов, располагающихся на семи f-орбиталях. В многоэлектронном атоме энергия электронов на s-, p-, d- и f- подуровнях разная (строго говоря, речь идет об энергии всего атома, соответствующей нахождению электрона на том или ином уровне, но для простоты мы часто говорим просто об энергии данного электрона). Минимальная энергия соответствует s-подуровню, затем в порядке возрастания энергии следуют p-, d- и f- подуровни. Переход от атома водорода к атомам с последующими атомными номерами можно представить себе как происходящий путем последовательного введения протонов в ядро, сопровождающегося увеличением его заряда, а также соответствующего количества электронов в электронную оболочку атома. В свободном, невозбужденном, атоме (содержащем электроны в состоянии, отвечающем минимуму энергии) новый электрон попадает на тот свободный подуровень, который характеризуется минимальной энергией, т.е. соответствует минимуму энергии всей системы, состоящей из ядра и окружающих его электронов. Поэтому при увеличении заряда ядра атомов от водород до аргона включительно последовательно заполняются первый, второй и третий уровни причем сначала s-, p- подуровни. На третьем уровне максимальное число электронов равно 18 (два электрона на s- подуровне, 6 электронов – на p-подуровне и 10 - на d - подуровне). Однако после заполнения 3s- и 3p- подуровней следующие два электрона попадают не на 3d-, а на 4s- подуровень, начиная застройку четвертого уровня – в этом случае энергия системы оказывается более низкой, чем при попадании электронов на 3d - подуровень. И лишь после кальция (Z = 20) начинается заполнение 3d - подуровня, что соответствует элементам с порядковыми номерами от 21 (скандий) до 30 (цинк) включительно. У цинка третий подуровень оказывается целиком заполненным, поэтому у следующих за ним шести элементов заполняется 4p- подуровень. При последовательном увеличении заряда ядра периодически повторяется как количество электронов, находящихся на внешнем уровне, так и симметрия их облаков. свойства химических элементов определяются строением электронных оболочек их атомов и прежде всего электронами, находящимися на внешнем уровне, которые выступают в роли валентных электронов, т.е электронов, ответственных за химические связи, образуемые данным атомом как с такими же, так и с другими атомами. Валентные электроны определяют все химическое поведение элемента. Поэтому с возрастанием атомного номера (заряда ядра) свойства химических элементов также изменяются периодически. Таким образом, именно периодическое появление аналогичных электронных конфигураций является физической причиной периодичности, составляющей сущность периодического закона, открытого Д.И. Менделеевым в 1869 г. Важно отметить, что периодический закон был открыт Менделеевым еще задолго до того, как было установлено, что атомы состоят из ядер и электронов. Менделеев положил в основу формулировки периодического закона атомную массу (по терминологии того времени – «атомный вес»), но тем не менее в некоторых случаях расположил элементы не в порядке возрастания атомных масс, а в том порядке, который диктовался всей совокупностью их свойств. В настоящее время периодический закон формулируется так: свойства элементов, а также образуемых ими простых и сложных веществ являются периодической функцией от зарядов их ядер. Открытие периодического закона позволило Менделееву объединить все химические элементы, часто весьма непохожие один на другой, в единую естественную (т.е. основанную на объективном признаке) систему – периодическую систему – и показать, что свойства элементов и образуемых ими конкретных веществ закономерным образом зависят от их положения в этой системе. Таким образом, периодический закон и периодическая систем элементов составили основу химической систематики. Одновременно с открытием периодического закона и на основании его Менделеев предсказал свойства нескольких неизвестных тогда элементов, а также исправил атомные массы ряда элементов. Наиболее детально и точно были предсказаны им свойства элементов с вероятными атомными массами 44, 68 и 72. Вскоре были открыты эти элементы, получившие названия «галлий» (Ar=69,7), «скандий» (45,0) и «германий» (72,6). Предсказания Менделеева были блестяще подтверждены экспериментальными данными о свойствах простых веществ и соединений этих элементов. Открытие периодического закона и утверждение в науке учения о периодичности стимулировало развитие теории строения атома и тем самым оказало огромное влияние на развитие не только химии, но также физики и других связанных с физикой и химией наук. В дальнейшем к известным элементам прибавилась группа открытых после 1893 г. инертных газов. В 1912 г. Мозли показал, что основой периодичности являются не атомные массы, а заряды ядер. Исследования Мозли подтвердили правильность расположения в периодической системе тех элементов, которые, если использовать атомные массы как основу для системы, стояли не на своем месте: это кобальт (Ar=58,9) перед никелем (58,7), теллур (127,6) перед йодом (126,9) и аргон (39,9) перед калием (39,1). С точки зрения заряда ядра эти элементы были размещены в системе правильно. Одновременно был уточнен и вопрос о числе еще не открытых элементов до урана (Z=92). В частности, было доказано, что в первом периоде нет элементов между водородом и гелием и что общее число элементов между барием и танталом, где предполагалось существование еще не открытых элементов, равно 16.
Слои расположены в порядке заполнения подуровней. s-элементы p-элементы d-элементы f-элементы
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Свойства элементов периодически изменяются в соответствии с зарядом ядер их атомов.
Постепенно переходя к атомам со все большим и большим зарядом ядра (и, следовательно, со все большим числом электронов), мы неизбежно столкнемся с элементами, у которых начинает заполняться d-подуровень. В ряду заполнения подуровней (1s, 2s, 2p, 3s, 3p, 4s, 3d ...) первый встретившийся нам 3d-подуровень начинает заполняться электронами после 4s-подуровня.
Элемент с валентной оболочкой ...4s2 - это кальций 20Ca. Следовательно, элемент с зарядом ядра Z = 21 (скандий 21Sc) будет первым d-элементом с валентной оболочкой ...4s2 3d1.
Поскольку существует пять d-орбиталей, каждая из которых может вмещать только 2 электрона, постепенное их заполнение электронами должно дать 10 d-элементов. Это видно из табл. 4-4, где приведены электронные формулы элементов, начиная с 11Na до 21Sc (первого d-элемента) и дальше - до 10-го по счету d-элемента цинка 30Zn. Атомные номера d-элементов в табл. 4-4 выделены наклонным шрифтом.
Таблица 4-4. Электронные конфигурации элементов 3 и 4 периодов Периодической таблицы Д. И. Менделеева.
Пери-од |
Z |
Эле-мент |
1s |
2s |
2p |
3s |
3p |
3d |
4s |
|
3-й |
11 12 13 14 15 16 17 18 |
Na Mg Al Si P S Cl Ar |
2 2 2 2 2 2 2 2 |
2 2 2 2 2 2 2 2 |
6 6 6 6 6 6 6 6 |
1 2 2 2 2 2 2 2 |
1 2 3 4 5 6 |
|
|
s-элементы (11, 12)
p-элементы (13-18) |
4-й |
19 20 21 22 23 ... 30 .... |
K Ca Sc Ti V ... Zn ... |
2 2 2 2 2 ... 2 ... |
2 2 2 2 2 ... 2 ... |
6 6 6 6 6 ... 6 ... |
2 2 2 2 2 ... 2 ... |
6 6 6 6 6 ... 6 ... |
1 2 3 ... 10 ... |
1 2 2 2 2 ... 2 ... |
s-элементы (19, 20)
d-элементы (21-30)
и так далее |
В традиционной (ее называют короткой) форме Периодической таблицы первый d-элемент скандий (Sc) попадает в клеточку, расположенную сразу за кальцием (Ca) - то есть в одну группу с бором (B) и алюминием (Al).
Но бор и алюминий - p-элементы. Их химические свойства не могут быть аналогичны свойствам d-элементов. Поэтому скандий помещен в одной группе с бором и алюминием, но не прямо под символами этих элементов, а в стороне - в так называемой побочной подгруппе. Так же пришлось поступить и с другими d-элементами (см. Периодическую таблицу). Итак, символы d-элементов в короткой форме периодической таблицы располагают не под символами других элементов данной группы, а выделяют в отдельную побочную подгруппу. d-Элементы также выделяют цветом (чаще - голубым). Например: d-элементы титан (Ti), цирконий (Zr), гафний (Hf) и резерфордий (Rf) - это элементы побочной подгруппы IV-й группы. А p-элементы углерод (C), кремний (Si), германий (Ge), олово (Sn) и свинец (Pb) - это элементы главной подгруппы той же IV-й группы.
В короткой форме Периодической таблицы каждая группа элементов подразделяется на главную подгруппу и побочную подгруппу. В главную подгруппу входят s- и p-элементы, в побочную - d-элементы.
Или, в другой формулировке:
Подгруппы, в которых расположены s- и p-элементы, называют ГЛАВНЫМИ, а подгруппы с d-элементами - ПОБОЧНЫМИ ПОДГРУППАМИ. Главные и побочные подгруппы иногда обозначают соответственно буквами "А" и "Б", или "А" и "В", или "а" и "б".
Элементы побочных подгрупп (d-элементы) называют ПЕРЕХОДНЫМИ элементами или переходными металлами (все d-элементы - металлы).
Термин “переходные металлы” возник вследствие того, что все d-элементы в периодах (строчках таблицы) служат как бы “переходным мостиком” от металлических s-элементов к p-элементам, среди которых уже много неметаллов. Иногда термин “переходные металлы” применяют и к f-элементам, о которых мы расскажем в следующем параграфе.
Поскольку в периодах (горизонтальных строчках Периодической таблицы) имеется всего по 2 s-элемента и по 6 p-элементов (в сумме 8), а d-элементов по определению должно быть больше (10 в каждом периоде), возникла масса неудобств в оформлении таблицы. Например, в VIII группе вместе с инертными газами (главная подгруппа) пришлось расположить не по одному, а по 3 элемента побочной подгруппы в каждой строчке!
Разумеется, ярко выраженные металлы - железо (Fe), кобальт (Co), никель (Ni) и другие элементы этой побочной подгруппы ничего общего не имеют с элементами главной группы: гелием, неоном, аргоном и другими инертными газами.
Электронное строение и химические свойства элементов главных и побочных подгрупп могут не иметь ничего общего.
Совпадения носят скорее случайный характер. Например, скандий (Sc) имеет валентную оболочку из трех электронов: ...4s2 3d1, поэтому проявляет в соединениях валентность III и степень окисления +3 точно так же, как его соседи (но в главной подгруппе) бор (2s2 2p1) и алюминий (3s2 3p1).
Другой пример: элемент побочной подгруппы марганец (Mn ...4s2 3d5) может отдавать с валентной оболочки 7 электронов и иметь наибольшую степень окисления +7 точно так же, как находящиеся с ним в одной группе (но в главной подгруппе!) хлор, бром, иод. Но в I-й и особенно в VIII-й группах очень хорошо видно, насколько разные элементы собрались в главной и побочной подгруппах. Здесь действительно нет ничего общего между элементами главных и побочных подгрупп.
Существует гораздо более удобная - так называемая “длинная” форма Периодической таблицы, где эти трудности устранены. Именно длинная форма Периодической таблицы рекомендована ИЮПАК (см. словарь терминов) к использованию во всем мире еще в 1989 году. Здесь нет подгрупп, а есть только группы. Идея этой таблицы ясна из рис. 4-4.
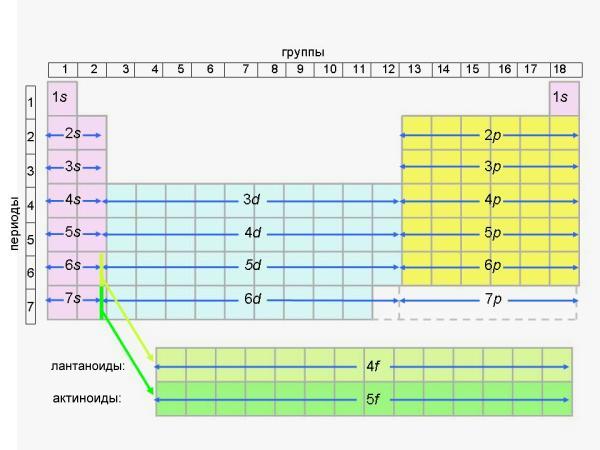
Рис. 4-4. Схема расположения s, p, d и f-элементов в длинной форме Периодической таблицы
Вызовите из меню длинную форму Периодической таблицы и сравните ее с рис. 4-4. В длинной форме не восемь, а восемнадцать групп (и по правилам ИЮПАК они нумеруются не римскими, а арабскими цифрами). Десять d-элементов выделены в 10 самостоятельных групп. Вместе с двумя группами для s-элементов и шестью группами p-элементов общее количество групп составляет 18. В короткой форме таблицы только VIII групп - именно поэтому группы пришлось делить на подгруппы.
Из-за большего числа групп в длинной форме таблицы ее периоды уже не нужно делить на ряды. Ряды существуют только в традиционной (короткой) форме таблицы Менделеева для того, чтобы поместить 18 элементов в VIII колонок (групп). Из-за d-элементов в короткой форме таблицы в каждом периоде (начиная с 3-го, где появляются d-элементы) - по два ряда. В длинной форме ряды оказываются не нужны - там каждый период состоит только из одной строчки.
Длинная форма таблицы имеет еще одно важное достоинство - с ее помощью легко восстановить в памяти последовательность заполнения электронами уровней и подуровней в атомах элементов (это особенно важно на экзамене). Вместо того, чтобы запоминать уже известный нам ряд:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f 6d, ...
можно по памяти начертить рис. 4-4 (это легче, чем может показаться на первый взгляд). В длинной форме таблицы все подуровни идут строго один за другим сверху вниз: под 1s мы видим 2s, 3s, и т.д.; под 2p мы видим 3p, 4p, и т.д.; под 3d мы видим 4d, 5d, и так далее. После этого сразу становится ясной последовательность заполнения всех электронных уровней любого элемента, даже еще не открытого. Нужно только помнить, что после 6s-подуровня заполняется 4f-подуровень, а после 7s-подуровня заполняется 5f-подуровень; f-элементы обычно выносят в отдельные строчки внизу таблицы, чтобы не делать ее “сверхдлинной” (такая таблица тоже существует и является наиболее строгой и логичной среди всех существующих форм Периодической таблицы, но она неудобна для печати).
Кстати, из длинной формы таблицы и рис. 4-4 следует, что начиная со 113-го элемента наступит черед открытий элементов, заполняющих свой 7p-подуровень.
Разумеется, длинная форма Периодической таблицы смогла появиться только после того, как выяснилось электронное строение атомов и стало понятно отличие d-элементов от s- и p-элементов.
Несмотря на рекомендации ИЮПАК 1989 года, в России традиционно продолжают пользоваться короткой формой таблицы Д. И. Менделеева. Именно на нее ориентированы задания ЕГЭ и программы по химии. Только она (за редким исключением) до сих пор печатается в российских школьных учебниках. Разумеется, это неправильно и надо постепенно исправлять ситуацию. Но в любом случае полезно разбираться и в короткой форме Периодической таблицы, которая еще долго будет присутствовать в российском школьном образовании. Тем не менее, будущее, безусловно, за длинной формой Периодической таблицы.
