
- •Атмосфера
- •Непостоянные газовые примеси природного происхождения:
- •Состав сухого атм. Воздуха на уровне моря в %объёмных.
- •Загрязнение атмосферы.
- •Естественные источники загрязнения атмосферы.
- •Антропогенное загрязнение атм воздуха
- •Классификация и характеристика зв.
- •Почва. Строение. Происхождение. Функции. Свойства.
- •Химические реакции в атмосфере.
- •3Й путь окисления so2 связ. С пердварительной адсорбцией so2 частичками воды. В дождь при выс.Влажности атмосферы so2 растворяется в частицах воды.
- •Алканы.
- •Алкены.
- •Озоновый слой атмосферы.
- •Составные части почвы.
3Й путь окисления so2 связ. С пердварительной адсорбцией so2 частичками воды. В дождь при выс.Влажности атмосферы so2 растворяется в частицах воды.
SO2+H2O↔H2SO4↔H++HSO3-↔2H++SO32-
Устанавл.динамич.равновесие м∕у растворенным в воде SO2 и ионами. При ph раствора <чем 3,5 в H2O отсутствуют ионы HSO3-,Нет ионов SO32- ? а для SO2 ~1.
С повышение ph до 7 и выше, доля растворимого в воде SO2 снижается до 0. В этихрастворах все соед. S нах. В виде HSO3- и SO32- Это чрезвычайно важно с точки зрения проц. Окисления SO2, т.к очень легко окисляются (HSO3- SO32-) до HSO4- даже в присутсвии озона и кислорода. В процессе окисления SO2 в жидк.фазе активное участие принимают свободные радикалы. HO2-гидропероксид R
HO2+H2O→H2O2+O∙ H H2O2 акт.участие в окислении до H2SO4
Конечный продукт окисления SO2 в растворе явл. H2SO4
Образование в виде мелкодисперсных аэрозолей с маленькой скоростью соединения
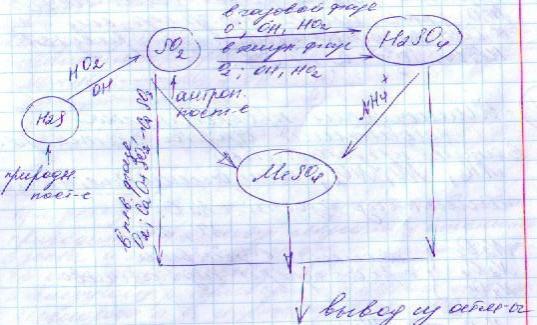
Вывод из атмосферы осадками и процессов сухого осаждения. Сам. Высок.коэф. -сух.осаждение SO2 и вымывание H2SO4 атм.осадками.
Выброс SO2
В первый момент после выброса в атм.практически отсутствуют ионы H2SO4 и сульфаты. Со временем доля SO2 в возд.снижается, одновременно растет доля серы в виде серной кислоты и сульфатов. При скорости ветра 8-9 м/скол-во H2SO4 в атмосфере достигает макс.спустя 10 часов после выброса,а сульфатов 30-40 часов.Результаты важны с точки зр.оценки последствий трансграничного переноса соединений серы.
Трансграничный перенос-перенос ЗВ на расст.более 100км. Т.о при оценке тр.гр.переноса соединений серы в возд.следует контролировать при отсутствии H2SO4 SO3- а не SO2
N
Химические превращения соединений азота в атмосфере.
В атм. NH3, NO2, соли аммония, HNO3
N2O3 →оксиды в
N2O4 → условиях тропосферы
N2O5 → неустойчивы
N2O3→NO+NO2 ; N2O4→NO2+NO2 ; N2O5→N2O3+O2 ; N2O5+H2O→2HNO3
Гемиоксид азота N2O
Осн.проц.вывода N2O из атмосферы связан с протеканием х.р.: 1) 2O+hV→N2+O. L<250 нм
2) 2O+O. →N2+O2 ; N2O+O. →2NO
Посколько в тропосфере конц.атомарного кислорода явл. Низкой и нет излучения с длиной волны 250нм, то молекулы N2O явл.устойчивыми. В стратосфере конц.атомарного кислорода увелич.с изменением спектра излучения и это приводит к увеличению скорости разрушения молекулы N2O. Оксид и диоксид азота в атмосфере подвергается взаимным превращениям NO+HO2→NO2+O.H (1) ; NO +O3→NO2+O2(2)
Константа при 250С (1) на 2 порядка больше чем (2)
Реакции с NO2
При реакц.с участием NO2 поглощ.излуч-я с L=410нм приводит к разрыву связей между атомами азота и кислорода и обр-ю атомарного кислорода и оксида азота.Последующ. реакция приводит к образ-ю молекул.кислорода и озона и регенерации NO2
NO2+hV→NO+O. (1) NO2+ O. →NO+O2 (2) O.+O2→O3 (3) NO+O3→NO2+O2 (4)
Регенерированный диоксид азота может вновь вступить в реакцию и этот процесс может повторяться многократно, пока ТЩ2 не превратится в азотную кислоту или в нитросоединения (с NH3)
Даже малые конц. NO2 в атмосфере могут явиться причиной образования значительных количеств атомарного кислорода и озона.
Важной частью атмосферного цикла азота является образование HNO3
NO2+O.H→HNO3 Часть азотной кислоты разлагается HNO3+hV→NO2+ O.H
Основное кол-во азотной кислоты выводится из атмосферы с осадками в виде растворов этой кислоты и её солей. Среди нитратов,присутсвующих в атмосфере осн.кол-во составляет азотно-кислый аммоний, кот.образуется в рез-те взаимодействия NH3 с кислотой.
