
- •Развитие современных представлений о строении атома: эксперименты Томсона и Резерфорда. Модель атома н. Бора. Постулаты Бора. Достоинства и недостатки этой модели.
- •Принципы формирования электронных оболочек атомов: принцип Паули и следствия из него, правило Гунда, принцип наименьшей энергии и правила Клечковского. Что такое «проскок электрона»?
- •Принцип построения периодической системы элементов: периоды, ряды, группы и подгруппы. Какая закономерность является наиболее важной в периодической системе с позиции строения атомов элементов.
- •Дайте определение химической связи. Каковы общие представления о химической связи? Основные характеристики химической связи.
- •Ковалентная химическая связь и ее характеристики. Образование общих электронных пар по обменному и донорно-акцепторному механизму.
- •Межмолекулярное взаимодействие: вандерваальсовы силы и водородная химическая связь. Аномальные свойства воды и их объяснение с позиции ее строения.
- •Общие понятия химической термодинамики. Первый закон термодинамики. Энтальпия и закон Гесса. Расчет тепловых эффектов химической реакции.
- •Второй и третий законы термодинамики. Физический смысл энтропии и ее изменение в химических превращениях.
Принцип построения периодической системы элементов: периоды, ряды, группы и подгруппы. Какая закономерность является наиболее важной в периодической системе с позиции строения атомов элементов.
Периодическая система состоит из периодов, рядов и групп.
Период – горизонтальный ряд элементов, имеющий одинаковое число энергетических уровней (электронных слоёв), номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя). Периодов в системе 7 , их них 1-3 короткие, 4 -7 длинные, которые имеют чётные и нечётные ряды. Каждый период начинается типичным металлом (щелочным элементом), имеющим электронную конфигурацию ns1, а при переходе слева направо происходит постепенное ослабление металлических и нарастание неметаллических свойств; заканчивается период благородным газом (ns2np6) . По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – A, состоящие из s- и p-элементов, и побочные – B -подгруппы, содержащие d - и f-элементы. Подгруппа II IB, кроме d-элементов, содержит по 14 4 f и 5 f -элементов. Это семейства лантаноидов и актиноидов соответственно. Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы. В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных – на s -орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f -элементов валентными являются (n-2)f, (n-1)d и sn- электроны, где n равно 6 или 7 для лантаноидов и актиноидов соответственно. Сходство элементов внутри каждой подгруппы – наиболее важная закономерность в периодической системе; они называются элементами – аналогами.
Дайте определение атомного радиуса. Как изменяется атомный радиус в периодах и группах периодической системы химических элементов, в зависимости от типа химической связи и степени окисления элемента?
Абсолютный радиус атома нельзя измерить, так как электроны обладают двойственной природой. Поэтому за радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром, так как происходит одновременное увеличение положительного заряда ядра и отрицательного заряда, создаваемого электронами. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек. В связи с этим возрастают и металлические свойства элементов. При изучении строения молекул было установлено, что радиусы атомов существенно зависят от типа химической связи и степени окисления элемента. Следовательно, чем больше перекрытие электронных облаков атомов при образовании молекул, тем меньше радиус атома. Аналогичная ситуация наблюдается при изменении степени окисления элементов – радиусы уменьшаются при увеличении степени окисления. У элементов главных подгрупп радиусы атомов действительно существенно изменяются как при переходе вдоль периода слева направо (они уменьшаются), так и в группах сверху вниз (они увеличиваются). В побочных подгруппах изменения радиусов сверху вниз происходит не столь заметно, что объясняется, с одной стороны, эффектом экранирования, когда валентные электроны заполняют d- и f-подуровни внутренних энергетических уровней, а с другой стороны, эффектом d- и f-сжатия – постепенным уменьшением вдоль периода атомных и ионных радиусов.
Что такое энергия ионизации? Что такое сродство к электрону? Как изменяется окислительно-восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера?
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбуждённого атома или иона. Энергия ионизации I выражается в кДж∙моль-1. Энергия ионизации характеризует металлические (восстановительные) свойства элементов. Чем меньше энергия ионизации, тем в большей мере элемент проявляет металлические свойства.
Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Она характеризует способность атомов проявлять неметаллические свойства. Чем больше
электронное сродство, тем более сильным окислителем является данный элемент. Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных оболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы). Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p2 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Что такое электроотрицательность? Понятие об относительной и абсолютной электроотрицательности. Как изменяется электроотрицательность р-элементов в периоде и группе периодической системы с увеличением порядкового номера?
Электроотрицательность – это количественная мера стремления данного атома к присоединению электронов, участвующих в образовании химической связи. При определении значения относительной электроотрицательности различных элементов за единицу принята ЭО лития, равная 1. Чем выше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства. Внутри групп электроотрицательность уменьшается - металлические свойства элементов возрастают сверху вниз.
Дайте определение валентности. От чего зависит валентность с современных представлений о строении атома. С чем связанна постоянная и переменная валентность элементов. Покажите на примере. Чем отличается валентность от степени окисления.
Классическое определение: Валентность – это свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента при образовании химической связи в молекуле.
Современное определение: Валентность элемента определяется числом неспаренных электронов в его атоме.
Существуют элементы с постоянной и переменной валентностью. Атомы многих элементов могут увеличивать свою валентность (число неспаренных электронов) в результате перехода из основного в возбуждённое состояние. Возбуждённое состояние атома – это состояние с более высокой энергией, чем основное.
Рассмотрим атомы кислорода и серы. Они имеют одинаковую электронную конфигурацию внешнего энергетического уровня потому, что находятся в главной подгруппе VI A группы:
![]()
В основном (невозбуждённом) состоянии они имеют по два неспаренных электрона на внешнем энергетическом уровне и поэтому имеют одинаковую валентность, равную двум.
Однако атом серы может перейти в возбуждённое состояние (при получении дополнительной энергии) за счет перехода электронов с 3s- и 3p- подуровней на свободные орбитали 3d-подуровня:
Основное
состояние
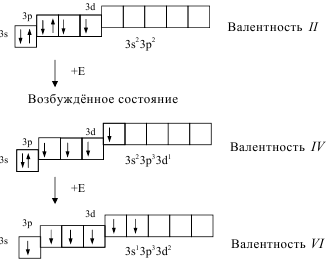
Это является причиной переменной валентности серы. Причём распаривание электронов и переход их с одного подуровня на свободную орбиталь другого подуровня может осуществляться только в пределах одного и того же энергетического уровня.
Другая
ситуация наблюдается для атома
кислорода. Он не может перейти в
возбуждённое состояние, потому что
на втором энергетическом уровне
отсутствует d-подуровень, т.е. нет
свободных орбиталей, на которые могли
бы перейти электроны. Именно поэтому
валентность кислорода постоянна во
всех его соединениях.
![]()
Валентность - это свойство атомов образовывать хим. связи, а степень окисления - условный заряд атомов хим. элемента в соединении, вычисленный на основе предположения того, что все соединения состоят из ионов.
