
РЕФЕРАТ ПО ХИМИИ
тема : УГЛЕВОДОРОДЫ
Сделала уч-ца10 кл.(э)
Гимназии АЛЬМА МАТЕР
Филимонова Юля
11.11.2011
СОДЕРЖАНИЕ
Определение
Классификация
Строение ,свойства,получение на примере алканов.
Природные источники углеводородов
Применение углеводородов
Список лит-ры
(1)
определение
Углеводороды – органические вещества, алифатические, алициклические и ароматические соединения, в состав молекул которых входят только атомы углерода и водорода. В. образуют гомологические ряды. В природе углеводороды встречаются в жидком, твердом и газообразном состоянии. В рассеянном виде присутствуют в атмосфере, воде, (кероген), в концентрированном – в залежах угля, нефти, газа, газогидратов. В зависимости от строения различают ациклические (алифатические углеводороды, в молекулах которых атомы образуют линейные или разветвленные цепи, и изоциклические, (карбоциклических) В., молекулы которых представляют собой циклы (кольца) трех и более атомов С. Углеводороды делят на две большие группы: на углеводороды с открытой цепью углеродных атомов, которые называют алифатические, и на углеводороды с замкнутым цепью, которые называют циклическими. Ациклические углеводороды делятся на насыщенные (алифатические), имеющих только простые связи(метан и его гомологи), и ненасыщенные, в молекулах которых есть кратные связи – двойные и тройные. Наличие кратных связей обусловливает способность В. этих гомологич. рядов к реакциям присоединения и полимеризации. Насыщенные В. метанового ряда (алканы, парафины) является осн. составной частью нефтей и газов природных горючих. Изоциклические углеводороды делятся на алициклические и ароматические с кольцеобразной структурой с 6 углеродных атомов (бензольное кольцо). Алифатические углеводороды, в свою очередь, делят на две подгруппы: на насыщенные углеводороды, в молекулах которых атомы углерода связаны между собой только простыми одинарными связями, и на ненасыщенные углеводороды, в молекулах которых между атомами углерода имеются двойные и тройные свя связки. Циклические углеводороды тоже делят на две подгруппы: на циклопарафины и ароматические углеводороды. Последние отличаются наличием в молекулах так называемого бензольного кольца, или ядра, состоящего из шести атомов углерода, связанных между собой в перемижку одинарными и двойными связями. Ароматические полициклические структуры свойственные гумусовым отмена вещества органической и кол-во их растет по мере метаморфизма, с приближением структуры органич. вещества в структуру графита. Всегда присутствуют в нефтях, но редко преобладают в их составе над других углеводородов.
(2)
классификация
Классификацию углеводородов проводят по следующимструктурным признакам, определяющим свойства этих соединений:
1) строение углеродной цепи (углеродного скелета); 2) наличие в цепи кратных связей С=С и С≡C (степень насыщенности).
1. В зависимости от строения углеродной цепи углеводороды подразделяютна две группы:
Ациклические или алифатические, т.е. "жирные" (от греческого слова "алейфар" – "жир", т.к. впервые структуры с длинными углеродными цепями были обнаружены в составе жиров):
Ациклические соединения — органические соединения, в молекулах которых отсутствуют циклы и все атомы углерода соединены между собой в прямые или разветвленные (открытые) цепи. Различают две основные группы ациклических соединений —насыщенные (предельные) углеводороды, у которых все атомы углерода связаны между собой только простыми связями (напр., гомологический ряд метана), и ненасыщенные (непредельные) углеводороды, у которых между атомами углерода имеются, кроме простых (одинарных) связей, также двойные, тройные связи (напр., ряды этилена, ацетилена).
Циклические:
ЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ Обычно циклические углеводороды делят на алициклические углеводороды (циклоалканы, циклоалкены и т.д.) и ароматические углеводороды.Кроме того, циклические структуры могут классифицироваться в зависимости от особенностей структуры на моноциклические, мостиковые (конденсированные циклы: бициклы, трициклы и т.д.) и спиро-циклы. В мостиковых структурах как минимум два атома принадлежат двум циклам, а у спиросоединений только один атом является общим для двух циклов.

Открытая (незамкнутая) цепь алифатических углеводородов может бытьнеразветвленной или разветвленной. Углеводороды с неразветвленнойуглеродной цепью называют нормальными (н-) углеводородами.
Среди циклических углеводородов выделяют:
алициклические (т.е. алифатические циклические);
ароматические (арены).
В этом случае классификационным признаком служит строение цикла.
К ароматическим углеводородам относят соединения, содержащие один или несколько бензольных циклов (формула бензолаС6Н6).
2. По степени насыщенности различают:
насыщенные (предельные) углеводороды (алканы и циклоалканы), в которых имеются только простые связи С-С и отсутствуют кратные связи;
ненасыщенные (непредельные), содержащие наряду с одинарными связями С-С двойные и/или тройные связи (алкены,алкадиены, алкины, циклоалкены, циклоалкины).
Иллюстрация с примерами
Следует заметить, что хотя по составу бензол С6Н6 формально соответствует ненасыщенным циклическим углеводородам (его молекулу часто изображаюткак шестичленный цикл с тремя двойными связями):

по свойствам это соединение резко отличается от ненасыщенных веществ из-за делокализации кратных связей .Поэтому соединения ряда бензола относят к самостоятельной группе ароматическихуглеводородов (аренов).
(3)
Строение,свойства,получение на примере алканов.
Строение:
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы, приведенные в разделе 2. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:
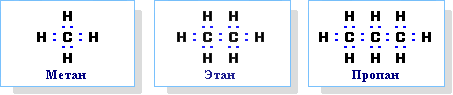
Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, раздел 4.3). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, раздел 4.3.1). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя σ-связи С-Н или С-С.
Четыре σ-связи углерода направлены в пространстве под углом 109о28', что соответствует наименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода:

Валентный угол Н-С-Н равен 109о28'. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.
|
|
Для записи удобно использовать пространственную (стереохимическую) формулу.

В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3-атома углерода образуют более сложную пространственную конструкцию:

Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана (VRML-модель) или н-пентана:

свойства:
Физические свойства
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; после C14H30 — твёрдые тела.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Химические свойства
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения
Галогенирование: Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Стоит отметить, что галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Сульфохлорирование (реакция Рида): При облучении УФ-светом алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.

Инициирование цепного процесса:
![]()
Развитие цепного процесса:
![]()
![]()
![]()
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование:
Основная статья: Реакция Коновалова
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
RH + HNO3 → RNO2 + H2O.
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления:
Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q.
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C) могут образоваться:
метиловый спирт: 2СН4 + О2 → 2СН3ОН;
формальдегид: СН4 + О2 → СН2О + Н2O;
муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Ниже представлена реакция окисления алканов диметилдиоксираном:

Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
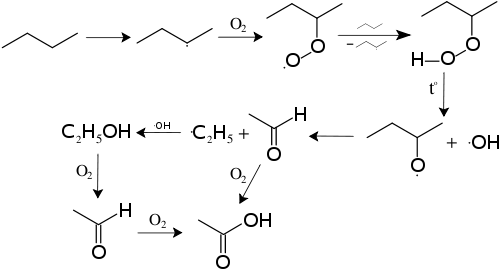
Термические превращения алканов:
Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 → C + 2H2 (t > 1000 °C).
C2H6 → 2C + 3H2.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
CH4 → С + 2H2 — при 1000 °C.
Частичный крекинг:
2CH4 → C2H2 + 3H2 — при 1500 °C.
Дегидрирование
Образование:
1)В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3.
а)CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б)CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
2)В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода:
в)CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3).
в')CH3-CH2-CH2-CH3 → CH2=C=CH-CH3 + 2H2 (бутан → бутадиен-1,2) (ЭТО — ОДНА РЕАКЦИЯ!)
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 3H2.
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4 + H2O → CO + H2.
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».

