Химическая связь и строение молекул.
Лишь немногие химические элементы, например благородные газы, в обычных условиях находятся в состоянии одноатомного газа. В большинстве же случаев наблюдается явно выраженная тенденция к объединению атомов в термодинамически устойчивые системы – молекулы, радикалы, молекулярные ионы, кристаллы и др. В настоящей лекции мы будем говорить о природе химической связи в молекулах, понимая, что природа химической связи в них, а также в других образованиях, принципиально одинакова.
И так, молекула – это термодинамически устойчивая динамическая система, представляющая собой совокупность ядер и электронов, которая характеризуется минимумом полной энергии системы.
Термодинамика процесса образования молекулы.
Образование молекул из атомов – процесс самопроизвольный и характеризуется уменьшением свободной энергии Гиббса ΔG < 0
ΔG = ΔН – ТΔS
ΔН – энтальпийный фактор;
ТΔS – энтропийный фактор.
Схема образования химической связи может быть представлена:
А + В = АВ
энтропия S1 S2
Так как при образовании молекулы происходит объединение атомов (т.е. уменьшение в системе числа микрочастиц), то (S2 < S1) энтропия такой системы уменьшается (ΔS < 0) и величина ТΔS будет положительной.
Следовательно, уменьшение энтропии не способствует образованию химической связи. Уменьшаться свободная энергия системы будет при условии ΔН < 0. Это свидетельствует о том, что основной причиной образования химических связей между атомами и образования молекулы является понижение полной энергии системы при переходе от свободных атомов к молекуле.
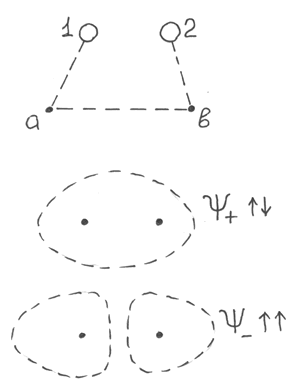
Химическая связь имеет электрическую природу. Возникновение электрических сил можно наглядно представить на модели:

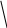


 а ° °в
а ° °в
 АО
ОВ
АО
ОВ
Типы электростатического взаимодействия:
Ядерноэлектронные взаимодействия Ав и Ва способствуют образованию химической связи.
Межэлектронные взаимодействия двух типов:
А) притяжение электронов с антипараллельными спинами (положительный фактор в образовании связи);
Б) отталкивание электронов с параллельными спинами (отрицательный фактор).
Межъядерное отталкивание АВ не способствует образованию химической связи.
Химическая связь представляет собой ядерно – электронное взаимодействие совокупности ядер и электронов, приводящее к минимуму полной энергии системы.
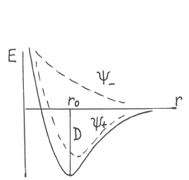
Гайтлер и Лондон (1927) получили графическую зависимость потенциальной энергии системы из двух атомов от расстояния между их ядрами. В том случае, если спины электронов связываемых атомов параллельны, энергия системы при сближении атомов неограниченно возрастает. Химическая связь при этом не образуется. Электронное облако имеет вид, как на рис
 Для
атомов с антипараллельными электронами
наблюдается понижение потенциальной
энергии системы, а по достижении минимума
– резкое её увеличение. На расстоянии
r0 силы притяжения
становятся равными силам отталкивания
и энергия системы становится минимальной.
Минимум на кривой потенциальной энергии
отвечает наиболее устойчивому состоянию
системы из двух атомов, т.е. образованию
молекулы и химической связи с энергией
связи Есв =432 кДж/моль и длиной
связи r0 = 0,74 А.
Что происходит с атомными орбиталями
при образовании химической связи? Для
случая антипараллельных спинов атомные
орбитали перекрываются между собой,
что приводит к накоплению электронной
плотности в межъядерном пространстве.
Эта плотность компенсирует энергию
межъядерного отталкивания и удерживает
ядра между собой. Электронное облако
имеет вид, как на рис. Если же спины
антипараллельны, накопления электронной
плотности в межъядерном пространстве
не происходит.
Для
атомов с антипараллельными электронами
наблюдается понижение потенциальной
энергии системы, а по достижении минимума
– резкое её увеличение. На расстоянии
r0 силы притяжения
становятся равными силам отталкивания
и энергия системы становится минимальной.
Минимум на кривой потенциальной энергии
отвечает наиболее устойчивому состоянию
системы из двух атомов, т.е. образованию
молекулы и химической связи с энергией
связи Есв =432 кДж/моль и длиной
связи r0 = 0,74 А.
Что происходит с атомными орбиталями
при образовании химической связи? Для
случая антипараллельных спинов атомные
орбитали перекрываются между собой,
что приводит к накоплению электронной
плотности в межъядерном пространстве.
Эта плотность компенсирует энергию
межъядерного отталкивания и удерживает
ядра между собой. Электронное облако
имеет вид, как на рис. Если же спины
антипараллельны, накопления электронной
плотности в межъядерном пространстве
не происходит.
|
Расширенное определение химической связи: химическая связь – это совокупность электронно – ядерных взаимодействий, приводящих к минимуиу потенциальной энергии системы.
Энергия связи – это энергия, которая выделяется при её образовании и которую необходимо затратить на её разрыв.
Длина связи – это расстояние между ядрами атомов, при котором система достигает минимума полной энергии.
Теории химической связи
В современной теории химической связи исрользуют два различных подхода для описания элктронного строения молекул:
метод валентных связей (ВС) исходит из существования двухцентровых локализованных связей (Ф.Лондон, В.Гейтлер, Л.Полинг).
Метод молекулярных орбиталей (МО) использует представления о многоцентровых делокализованных связях. (Р.Малликен, Ф.Гунд, Э.Хюккель и др.).
Основные положения метода валентных связей
Химическая связь между атомами образуется в результате обобществления валентных электронов, т.е. образования общих электронных пар.
Общие электронные пары образуют лишь неспаренные электроны с антипараллельными спинами.
При образовании химической связи происходит частичное перекрывание атомных орбиталей, что приводит к увеличению электронной плотности в межъядерном пространстве.
Химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие атомные орбитали.
В пространстве химическая связь располагается в том направлении, в котором возможность перекрывания электронных облаков наибольшая.
Свзь,образованная электронными облаками и имеющими максимальную плотность по линии, соединяющей центры атомов, называется сигма-связью (σ). Связь с максимальной электронной плотностью по обе стороны от линии, соединяющей центры атомов, - пи-связью (π).
Если молекула образуется путём перекрывания двух АО, связь называется одинарной, если более двух АО – кратной. Одинарная связь представлена всегда σ-связью, а кратные связи включают σ- и π-связи.
Общая электронная пара соответствует единице химической связи. Ковалентность элемента или его спинвалентнось определяется числом общих электронных пар, образующих химическую связь. Поскольку общие электронные пары образуют неспаренные электроны, то спинвалентнось определяется в первую очередь числом неспаренных валентных электронов в основном и возбуждённом состояниях атома.
↑↓ ↑↓
↑N↑ + 3Н↓ → Н↓↑N↑↓H Cпинвалентность атома азота равна трём.
↑ ↑↓
Ковалентная связь в молекуле аммиака образована по обменному механизму: электронная пара образуется за счёт обобществления двух электронов от двух атомов.
Образование ковалентной связи может осуществляться и по донорно-акцепторному механизму: неподелённую пару электронов представляет один из взаимодействующих атомов (донор), а свободную атомную орбиталь второй атом (акцептор). Такой механизм образования ковалентной связи реализуется, например, при образовании катиона аммония.
H
↑↓ ↑↓
Н↓↑N↑↓H + ٱН+ → [ Н↓↑N↑↓H ]+
↑↓ ↑↓
H H
донор акцептор
В катионе NH4+ азот проявляет свою максимальную валентность, равную четырём.
Ионная связь – крайний случай ковалентной полярной связи
Водородная связь