
Практическая часть.
Опыт 1.
а) Название эксперимента.
Перманганат калия как окислитель в различных средах.
б) Ход эксперимента
В ячейки капельного планшета я внесла последовательно 3 капли 0, 1М раствора перманганата калия КMnО4. В первую ячейку я добавила каплю 1М раствора серной кислоты Н2SО4, во вторую – каплю дистиллированной воды, в третью – каплю 2М раствора едкого кали КОН.
в) Наблюдения.
Ничего не происходит. Раствор не меняет фиолетового окраса.
г) Уравнения реакции.
КMnО4 + Н2SО4 =
КMnО4 + KОН = реакции не идут
КMnО4 + Н2О =
е) Вывод.
Так как мы не наблюдаем никаких изменений, то реакции не идут.
ж) Ход эксперимента.
В каждую из трех ячеек добавляем 2 – 3 капли 0, 12М раствора сульфита натрия Na2SO3.
з) Наблюдения.
Раствор с серной кислотой становится бесцветным. Раствор с дистиллированной водой становится гранатовым. А раствор с NаОН становится темно – зеленым.
и) Уравнения реакций.
2КMnО4 + 3Н2SО4 + 5Na2SO3 = 5Na2SO4 + 2MnSO4 + 3H2O + K2SO4
Mn+7 + 5ē = Mn+2 2 окислитель
S+4 - 2ē = S+6 5 восстановитель
2КMnО4 + 2KОН + Na2SO3 = Na2SO4 + K2MnO4 + H2O
S+4 - 2ē = S+6 1 восстановитель
Mn+7 + 1ē = Mn+6 2 окислитель
2КMnО4 + 3Н2О + 3Na2SO3 = 3Na2SO4 + 2MnO(OH)2 + 2KOH
S+4 - 2ē = S+6 3 восстановитель
Mn+7 + 3ē = Mn+4 2 окислитель
к) Иллюстрационный материал.
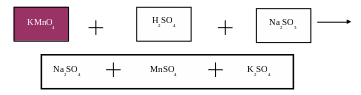
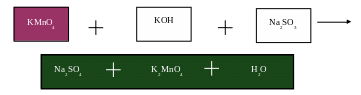
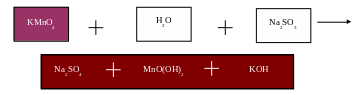
Вывод.
Перманганат калия КMnО4 в реакциях с серной кислотой Н2SО4 и сульфитом натрия Na2SO3, с гидроксидом калия КОН и сульфитом натрия Na2SO3, с дистиллированной и сульфитом натрия Na2SO3 выступает в роли окислителя. В реакции в кислой среде глубина восстановления перманганат – иона больше.
Опыт 2.
а) Название эксперимента.
Реакция контрпропорционирования: взаимодействие соединений йода.
б) Ход эксперимента.
В ячейку капельного планшета я внесла 1 каплю 0, 1М раствора KJ. Затем добавила 1 каплю Н2SО4.
в) Наблюдения.
Запах сероводорода. Окрас раствора бесцветный.
г) Уравнения реакции.
KJ + Н2SО4 = реакция не идет
е) Вывод.
При смешивании KJ и Н2SО4 взаимодействия не происходит.
ж) Ход эксперимента.
Добавляем в ячейку с раствором йодат калия KJO3 и затем, чтобы подтвердить образование йода, опускаем в получившийся раствор крахмальную бумажку.
з) Наблюдения.
Цвет раствора стал коричневым, после чего выпал черный осадок. А крахмальная бумажка стала темно – синей.
и) Уравнение реакции.
5KJ + 3Н2SО4 + KJO3 = 3J2 + 3H2O + 3K2SO4
2J- - 2ē = J20 5 восстановитель
2J+5 + 10ē = J20 1 окислитель.
к) Иллюстрационный материал.
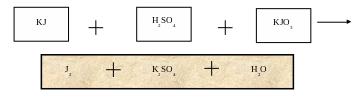
л) Вывод.
Окрашивание крахмальной бумажки указывает на то, что при взаимодействии йодида калия с йодатом калия выделился йод. Данный опыт указывает на то, что соединение йодида калия является восстановителем, а соединений йодата калия – окислителем.
Опыт 3.
а) Название эксперимента.
Пероксид водорода как окислитель и как восстановитель.
б) Ход эксперимента.
В ячейку капельного планшета я внесла каплю 0, 1М раствора йодида калия KJ, затем добавила каплю 1М раствора серной кислоты Н2SО4.
в) Наблюдения.
Раствор не меняет свою бесцветную окраску.
г) Уравнение реакции.
KJ + Н2SО4 = реакция не идет
е) Вывод.
При смешении KJ и Н2SО4 взаимодействия не происходит.
ж) Ход эксперимента.
К раствору приливаем 2 – 3 капли концентрированного раствора пероксида водорода Н2О2. И после взаимодействия опускаем туда крахмальную бумажку.
з) Наблюдения.
Раствор меняет свою окраску с бесцветного на желто – коричневую. Крахмальная бумажка становится темно – синей.
и) Уравнение реакции.
2KJ + Н2SО4 + Н2О2 = K2SO4 + J2 + 2H2O
2J- - 2ē = J20 1 восстановитель
О- + 1ē = О-2 2 окислитель
к) Иллюстрационный материал.
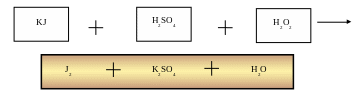
л) Вывод.
Окрас крахмальной бумажки в темно – синий цвет указывает на присутствие свободного йода J2. Пероксид водорода Н2О2 в данной реакции является сильным окислителем.
м) Ход эксперимента.
В пустую ячейку я внесла каплю 0, 1М раствора перманганата калия и каплю 1М раствора серной кислоты.
н) Наблюдения.
Раствор не меняет своей темно – фиолетовой окраски. Ничего не происходит.
о) Уравнение реакции.
КMnО4 + Н2SО4 = реакция не идет
р) Вывод.
Так как мы не наблюдаем никаких изменений, значит реакции не идут.
с) Ход эксперимента.
К раствору приливаем 2 – 3 капли концентрированного раствора пероксида водорода.
т) Наблюдения.
Выделяется газ. Раствор становится бесцветным.
у) Уравнение реакции.
2КMnО4 + 3Н2SО4 + 5Н2О2 = MnSO4 + K2SO4 + 5О2 + 8Н2О
Mn+7 + 5ē = Mn+2 1 окислитель
О- - 1ē = О0 5 восстановитель
ф) Иллюстрационный материал.
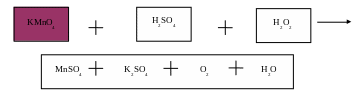
х) Вывод.
При взаимодействии пероксида водорода Н2О2 с более сильными окислителями выделяется кислород О2, и пероксид водорода Н2О2 становится восстановителем.
Опыт 4.
а) Название эксперимента.
Окислительная активность галогенов.
б) Ход эксперимента.
Я налила в одну пробирку 2 – 3 капли раствора йодида калия KJ, а в другую 2 – 3 капли бромида калия KBr. С помощью капельной пипетки добавила туда несколько капель хлорной воды Cl*nH2O.
в) Наблюдения.
Раствор йодида калия и хлорной воды имеет медный окрас, а раствор бромида калия и хлорной воды имеет желтый окрас.
г) Уравнения реакций.
KJ + Cl*nH2O = 2KCl + J2
Cl0 + 1ē = Cl- 2 окислитель
2J- - 2ē = J20 1 восстановитель
KBr + Cl*nH2O = 2KCl + Br2
Cl0 + 1ē = Cl- 2 окислитель
2Br- - 2ē = Br20 1 восстановитель
д) Иллюстрационный материал.
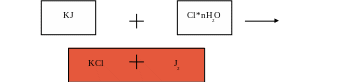

е) Вывод.
Хлор вытесняет бром и йод из их соединений с металлами.
Опыт 5.
а) Название эксперимента.
Селитра как окислитель.
б) Ход эксперимента.
В сухую пробирку, закрепленную вертикально, мы внесли 1 – 2 г нитрата калия. Затем нагрели пробирку до расплавления соли. Затем мы опустили в пробирку кусочек древесного угля. Продолжили нагревание до воспламенения угля.
в) Наблюдения.
Кристаллический белый нитрат калия становится жидким. Через некоторое время уголь воспламенился. Образовался осадок.
г) Уравнения реакции.
t0
4KNO3 + 5С → 2N2 + CO2 ↑ + 2K2CO3
2N+5 + 10ē = N20 2 окислитель
C0 - 4ē = C+4 5 восстановитель
д) Иллюстрационный материал.
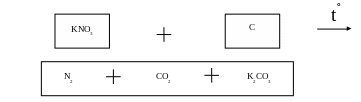
е) Вывод.
При нагревании нитрат калия превращается из кристаллического состояния в жидкое. При нагревании угля в растворе нитрата калия уголь воспламеняется. Образуется осадок.
ж) Ход эксперимента.
После окончания реакции и охлаждения пробирки, мы налили в нее дистиллированную воду до растворения осадка. Добавили несколько капель 1М раствора соляной кислоты.
з) Наблюдения.
Осадок растворился. Выделился газ.
и) Уравнения реакции.
K2CO3 + 2HCl = 2KCl + H2O + CO2 ↑
k) Иллюстрационный материал.
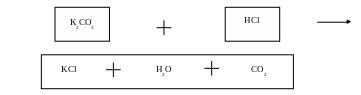
л) Вывод.
Реакция происходит с выделением тепла и огромного количества углекислого газа.
