
- •Билет 1.
- •1. Активность, коэффициент активности и способы их определения. Ограниченная и полная взаимная растворимость компонентов в различных фазовых состояниях. Диаграммы состояния.
- •2. Соли. Соли кислородсодержащих и бескислородных кислот. Склонность элементов к вхождение в состав солей в катионной и анионной формах в зависимости от природы элемента и степени окисления.
- •3. Сложные эфиры. Реакции этерификации и гидролиза сложных эфиров, их механизм. Жиры, их состав. Гидрирование и гидролиз жиров.
- •Билет №2
- •1. Ковалентная связь. Квантово-химическая трактовка природы химических связей и строения молекулы. Химическая связь в молекуле водорода.
- •2. Хроматография. Принципы хроматографического разделения. Параметры хроматограмм. Газовая, жидкостная и сверхкритическая флюидная хроматография.
- •ГомоПк.
- •Билет №3.
- •1. Основные положения теорий валентных связей и молекулярных орбиталей. Их сравнительные возможности.
- •2. Электроанализ: потенциометрия, вольтамперометрия, кулонометрия.
- •3. Радикальная, катионная, анионная полимеризация.
- •Билет 4.
- •1.Концепция гибридизации атомных орбиталей. Концепция отталкивания электронных пар. Простанственная конфигурация молекул и ионов.
- •2. Простые вещества, образуемые р-элементами. Аллотропия и полиморфизм. Химические свойства галогенов, кислорода, озона, халькогенов, азота, фосфора, углерода, кремния.
- •3. Нитросоединения. Способы получения и важнейшие свойства.
- •Билет 5
- •1. Нефть, её состав и переработка. Особенности строения и химический состав циклоалканов.
- •2. Спектральные методы анализа и исследования, люминесцентный, эпр- и ямр-спектроскопия.
- •3. Количественные характеристики химической связи: порядок, энергия, длина, степень ионности, дипольный момент, валентный угол.
- •Билет №6.
- •1. Трактовка ионной связи на основе электростатических представлений.
- •2. Оптические методы анализа. Атомно-эмиссионный, атомно-абсорбционный и молекулярно-абсорбционный анализ, реагенты и реакции в фотометрическом анализе. Экстракционно-фотометрический анализ.
- •3. Алкены, методы синтеза и общие представленияо реакционной способности. Присоединение электрофильных реагентов реагентов по двойной связи.
- •Билет №7
- •1. Типы координационной связи (особенности химической связи в комплексных соединениях). Донорно-акцепторный и дативный механизм ее образования.
- •2. Основные различия между нмс и вмс.
- •3. Сульфидный, кислотно-щелочной, аммиачно-фосфатный методы разделения катионов.
- •Билет № 8.
- •1. Метод валентных связей и его недостатки в применении к координационным соединениям. Теория кристаллического поля и мо в применении к комплексным соединениям.
- •2. Экстракционные и сорбционные методы разделения и концентрирования. Факторы, определяющие межфазный перенос компонентов в экстракции и сорбционных системах.
- •Билет №9
- •1. Методы исследования и способы описания геометрических параметров молекулы. Симметрия молекул. Основные виды изомерии молекул и принципы динамической стереохимии
- •2. Простые и комплексные соли. Кристаллогидраты. Гидролиз солей.
- •3. Алкадиены. Сопряженные диены, особенности их строения и свойств. Каучуки.
- •Билет 10.
- •1.Силы Ван-дер-Ваальса. Водородная связь.
- •2. Титриметрия. Кислотно-основное, комплексонометрическое и электрохимическое титрование. Кривые титрования. Индикаторы.
- •3. Алкины. Методы синтеза и важнейшие свойства алкинов. Ацетилен.
- •Билет 11
- •1. Энергетические параметры молекул. Понятие об энергии образования молекул. Энергетические состояния: вращательные, электронные и колебательные спектры молекул.
- •3. Ароматические углеводороды. Промышленное источники аренов, их химические свойства и применение. Механизм и закономерности реакций электрофильного замещения в ароматическом ядре.
- •Билет 12
- •1. Магнитные свойства молекул. Спектры электронного парамагнитного резонанса и ямр спектры. Принципы и возможности исследования структуры и свойств молекул.
- •4. Активация галогенпроизводных и генерация карбокатионов.
- •Билет 13
- •1. Основы тд анализа хим процессов. Постулаты и законы хим тд. Функция состояния: температура, внутр энергия, энтальпия, энтропия, энергии Гиббса и Гельмгольца.
- •2. Особенности свойств р-элементов II и V периодов.
- •3. Спирты и фенолы. Методы получения и сравнительная характеристика хим св-в. Этиленгликоль. Глицерин. Лавсан.
- •14 Билет
- •1.Условия равновесия и критерии самопроизвольного протекания процессов, выраженные через характеристические функции.
- •3.Особенности реакционной способности арилгалогенидов. Получение литий- и магнийорганических соединений, их применение в органическом синтезе.
- •Билет №15
- •1. Энергетика химических реакций, основные законы термохимии и термохимические расчеты.
- •2. Особенности изменения химических свойств d-элементов по группам и периодам по сравнению с p-элементами. Образование катионных и анионных форм, комплексообразование.
- •3. Фенолформальдегидные смолы. Простые эфиры. Методы синтеза и свойства. Диэтиловый эфир.
- •Билет 16
- •2. Гидриды. Типы гидридов: солеобразные, полимерные, летучие, гидриды внедрения. Типичные примеры и общая характеристика свойств каждой группы гидридов. Гидрокомплексы.
- •3. Правило Марковникова и его интерпретация. Реакция по аллильному положению.
- •Билет 17
- •1. Основные типы химической связи: ковалентная, ионная, металлическая. Многоцентровая, σ и π-связи
- •2. Гравиметрия. Варианты гравиметрии: осаждение, отгонка, выделение. Термогравиметрия. Реагенты-осадители: минеральные, органические.
- •3. Альдегиды и кетоны. Методы получения представителей, их свойства
- •Билет 18
- •1. Коллоидное состояние вещества. Особенности свойств дисперсных систем и их классификация. Получение и молекулярно-кинетические свойства дисперсных систем, их устойчивость.
- •2. Гидроксиды. Типы гидроксидов: гидроксиды с ионной, молекулярной, полимерной структурой.
- •3. Енолизация альдегидов и кетонов. Альдольная конденсация и родственные процессы. Реакции альдегидов и кетонов с гетероатомными нуклеофилами. Альфа-бета-непредельные карбинильные соединения.
- •Билет 19
- •2. Периодичность изменения хим св-в э-тов и образуемых ими соединений. Валентность и степень окисления.
- •3. Углеводы. Важнейшие представители моносахаридов, их строение и важнейшие свойства. Дисахариды и полисахариды, сахароза, крахмал, целлюлоза.
- •-Рибоза -дезоксирибоза Рибоза и дезоксирибоза входят в сотав рнк и днк соответственно. Основные реакции моносахаридов, продукты реакций и их свойства
- •Билет №20
- •1. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, понятие об энергии активации и методах ее определения.
- •3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
- •Билет №21.
- •3. Углеводороды. Алканы. Конформационная изомерия. Важнейшие свободнорадикальные реакции алканов.
- •Билет 22
- •1. Понятие о катализе и катализаторах. Гомогенный и гетерогенный катализ. Энергетические профили каталитических реакций. Основы теории гетерогенного катализа.
- •2. Комплексные соединения. Типичные комплексообразователи и лиганды. Пространственная конфигурация комплексных ионов. Особенности диссоциации комплексных соединений в растворе. Карбонилы металлов.
- •3. Амины. Типы аминов и их свойства. Особенности свойств ароматических аминов. Реакция диазотирования и её значение в органическом синтезе.
- •Билет 23
- •2. Радиоактивационный анализ. Масс-спектральный анализ. Рентгеновская фотоэлектронная спектроскопия. Инфракрасная спектроскопия.
- •3. Гетероциклические соединения, общие принципы их классификации. Важнейшие пятичленные и шестичленные, гетероароматические соединения с одним гетероатомом. Особенности их химических свойств.
- •Билет №24
- •1.Равновесные электродные процессы. Понятие о скачке потенциала на границе раздела фаз. Электрохимический потенциал. Образование и строение двойного электрического слоя.
- •2. Оксиды. Типы оксидов: оксиды с ионной, молекулярной и полимерной структурой.
- •Билет 25
- •3. Декструкция высокомолекулярных соединений. Сшивание высокомолекулярных соединений. Синтез и свойства привитых сополимеров.
3. Карбоновые кислоты и их производные. Методы синтеза, взаимные превращения.
Карбоновые кислоты содержат функциональную карбоксильную группу COOH, связанную с радикалом или атомом водорода.
Получение: 1). Окисление у/в, перв.спиртов, альдегидов, кетонов:

![]()
Галоформная реакция для метилкетонов:
![]()
Окисление алкилбензолов и др. алкиларенов (получение аромат.карб.кислот) в качестве окислителя применяются водн. щел. Или нейтр.р-ры перманганата калия, бихромата натрия в кислой среде или водная азотная кислота.
![]()
2. удлинение С- цепи:
Оксосинтез: СО + NaOH→HCOONa (H2SO4р)→HCOOH
Карбоксилирование реактивов Гриньяра:
![]()
Кислотный или щелочной гидролиз нитрилов:
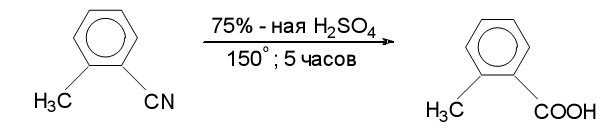
3. Гидролиз ацилгалогенидов, ангидридов, сложных эфиров, амидов и др.производных карб.кислот. Все производные при гидролизе в кислой или щелочной среде образуют карб.кислоты.
Реакции карб. кислот: Реакции карб. кислот можно разделить на несколько больших групп:
Восстановление к.к (к.к восстан. до первичных спиртов с пом литийалюминийгидрида: RCOOH
 RCH2OH
)
RCH2OH
)
Реакции декарбоксилирования
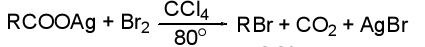
Реакции замещения при α-углеродном атоме к.к
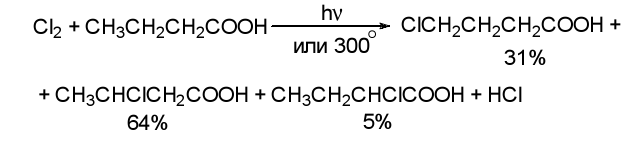
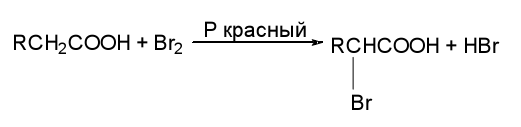
Реакции нуклеофильного замещения у ацильного атома углерода.
Производные карб.кислот: Функциональными производными карб. кислот обычно наз.такие классы соединений, которые при гидроизе дают сами кислоты. К ним относятся: сл. эфиры, тиоэфиры, амиды, гидразиды, азиды, ангидриды к.к , имидохлориды, амидины и нитрилы.
Образование сложных эфиров:
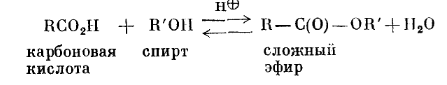
(Механизм этерефикации)
Билет №21.
1. Теории химической кинетики: теория активных соударений и теория активированного комплекса. Понятие о поверхности потенциальной энергии реагирующих частиц. Термодинамический аспект теории активированного комплекса.
Для частиц выполняется распределение Больцмана по Е:
Ni/N
= e![]() /
/![]() ,
и Максвелла по
,
и Максвелла по![]() Uвер.
= (2КТ/m)1/2
Uвер.
= (2КТ/m)1/2
Uср. = (8кТ/πm)1/2
z – число столкновений в ед. времени в единице объема
z11 = 2n2d2 (πkT/m)1/2=2n2d2(πRT/M)1/2
z12 = n1n2d122[8πkT(1/m1 + 1/m2)]1/2= n1n2d122[8πRT(1/M1 + 1/M2)]1/2
z11 – одинаков., z12 – разные, d – диаметр ч-цы, n – число ч-ц в 1 см3 d12- диаметр столкновения (эффективный), наименьшее расстояние между центрами сталкивающихся частиц.
d12=(d1+d2)/2 z12 = d122[…]1/2 = z0 – частота столкновений в ед. времени в ед. объема.
z12 = z0n1n2; z11 = z0n2
z0 = 2d2(πkT/m)1/2
A
+ A
![]() P
P
z11 = 2n2d2(πRT/M)1/2
z12 = n1n2d122[8πRT(1/M1 + 1/M2)]1/2
W = 2z11/NA, сравн. с реальн. Реальн. << расчит. (в 1014)
K реакции приведет столкновение активных ч-ц.
zакт = z11e-E/RT
W
= P
2 z11e![]() /
NA
/
NA
Р – стерический фактор
U
= At
=
De(1-
e![]() )
ф-ла
Морзе
)
ф-ла
Морзе
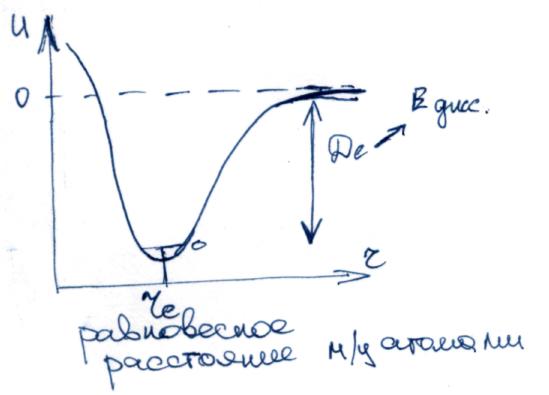
A – результат кулоновского взаимодействия
- обменное взаимодействие
U
= A
+ В +С +{1/2[![]() ]}1/2
ф-ла Лондона
]}1/2
ф-ла Лондона
А+В+С – вклады кулоновского взаимодействия
{….} – обменное взаимодействие в 2-х атомной системе
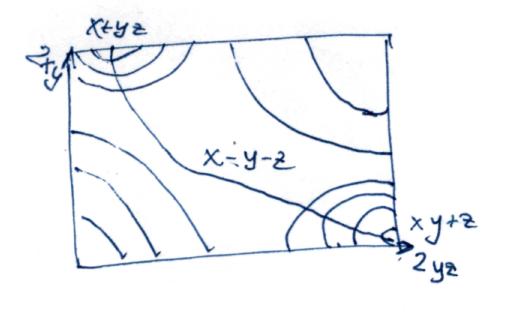
ППЭ представляет собой 2 долины (исх. и прод.), которые разделяются перевалом. Верхняя точка перевала – АК.
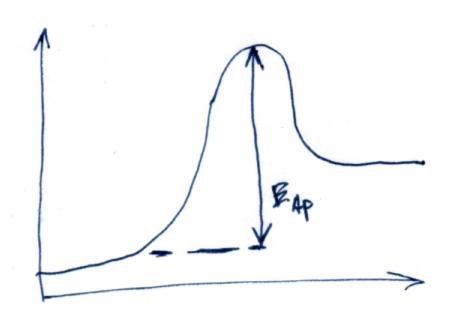
 Бимолекулярная
реакция.
Бимолекулярная
реакция.
А+В →С+Д W=k2CAB*
A+В ↔ АВ*→С+Д
Кравн.= (QAB*/QAQB)e-Ea/RT
m – число атомов
3m – степеней свободы
3 поступ. + 3 вращательных → (3m-6) колебаний
Для АК (3m-7) +1 поступ. (движение по координате реакции)
Р (необх. правильная ориентация сталкивающихся мол., Е д.б. распределена по линии, соединяющей центры атомов)
Р = 1-10‑8 (теория ТАС предполагает, что взаимодействие мгновенно, реально через образование промежуточного комплекса (богатого Е) и чтобы комплекс дал продукты нужно избыток Е отвести (столкновение с 3-й частицей)).
K=Ae-E/RT – Аррениус
КТАС=constT1/2 e-E/RT (const=Pz0)
dlnK/dT = EA/RT2 lnKTAC = lnconst +1/2lnT - ЕТАС/RT
d lnKTAC/dT = EA/RT2=1/2T + ЕТАС/RT2= (ЕТАС+1/2RT)/RT2
EAp= ЕТАС + 1/2RT
Мономолекулярные реакции. Схема Линдемана.
А→ В (А+А↔A* + A; A*→B*; B* +A→B + A*)
1) Стадия активации
A
+ M
(A,P
инертная частица)![]() А*
+М к1
= Pz0
e-E/RT
А*
+М к1
= Pz0
e-E/RT
2)А*
+ М![]() А
+ М к2
= Pz0
А
+ М к2
= Pz0
3)А*![]() Р
Р
W = k3CA* dCA*=0=k1CACM – k2CA*CM – k3CA*
CA*
= k1CACM/(k3
+ k2CM)
![]() W
= k3k1CACM/(k3
+ k2CM)
W
= k3k1CACM/(k3
+ k2CM)
↓ Рдавл столкновения редки, не б. дезактивации
k3 > k2CM W = k1CACM - как реакция 2-го порядка
↑ Р процесс к3 будет маловелик по сравнению с к2
k3 < k2CM W = k3k1CA/k2 - как реакция 1-го порядка
ТАК (Эвонс, Эйринг, Поляни – независимо предложили)
Основное положение: в ходе реакции происходит непрерывное изменение межатомных расстояний: x +yz →x….y….z →xy +z
Некоторое критическое состояние системы. Очень велика вероятность того, что произойдет превращение АК→Р. Т.к. Е системы зависит от взаимного расположения частиц, то по ходу реакции непрерывно меняется и Е системы. Одним из важный приближений – адиабатическое приближение: По ходу реакции мультиплетность системы не меняется в любой момент времени Есистемы зависит от межатомных состояний системы. Е = f(ryz, rxy) Считается, что по ходу реакции движение атомов происходит по линии, соединяющей центры 3-х атомов (Е в таком случае минимальна).
Можно построить поверхность потенциальной энергии.
2. Аналитическая классификация ионов и периодическая система химических элементов.
Классификация катионов
Сероводородная (сульфидная) классификация катионов.
Катионы |
Групповой реагент |
I. Li+ Na+ K+ NH4+ Mg2+ |
нет |
II. Ca2+ Sr2+ Ba2+ |
р-р (NH4)2CO3 в аммиачном буфере (рН ~ 9,2) |
III. Al3+ Cr3+ Zn2+ Mn2+ Fe2+/3+ Co2+ Ni2+ |
р-р (NH4)2S (pH ~ 7-9) |
Аммиачно-фосфатная
Катионы |
Групповой реагент |
I. Na+ K+ NH4+ |
нет |
II. Li+ Mg2+ Ca2+ Sr2+ Ba2+ Mn2+ Fe2+/3+Al3+ Cr3+ Bi3+ |
р-р (NH4)2HPO4 в водн. аммиаке (25%) |
III.Cu2+ Zn2+ Cd2+ Hg2+ Co2+ Ni2+ |
р-р (NH4)2HPO4 фосфаты раст-мы в водном аммиаке |
Кислотно-основная.
I. Li+ Na+ K+ NH4+ |
Нет |
II. Ag+ Hg22+ Pb2+ |
Р-ры HCl |
III. Ca2+ Sr2+ Ba2+ |
Р- ры H2SO4 |
Классификация анионов.
Основана на образовании малорастворимых солей бария и серебра
SO42- SO32- S2O32- CO32- PO43- F- |
Р-р BaCl2 в нейтральной или слабокислой среде |
Cl- Br- J- CN- NCS- |
Р-р AgNO3 в разб. (2М) HNO3 |
NO2- NO3- CH3COO- |
нет |
Основана на их окислительно-восстановительных св-вах
Окислители |
BrO3- AsO43- NO2- NO3- |
Р-р KJ в сернокислой среде |
S2- SO32- S2O32 AsO33- |
Р-р J2 в KJ |
|
Восстановители |
S2- SO32- S2O32- AsO33- NO2- Cl- Br- J- CN- NCS- |
Р-р KMnO4 в сернокислой среде |
Индифферентные |
SO42- CO32- PO43- CH3COO- |
нет |
